무기고분자 화학의 개요
김명희 전남대학교 화학과 박사과정/나노기술연구센터 연구원
조명식 광주지방식품의약품안전청 시험분석팀 보건연구사
우희권 전남대학교 화학과 (알란 멕디아미드 에너지연구센터 및 나노기술연구센터) 교수
서론 1_1 무기고분자의 탄생 배경과 신소재로서의 중요성
신소재는 기존의 재료와는 다른 뛰어난 특성과 새로운 기능을 갖고 있는 물질을 일컬으며, 인류문명은 이런 신소재의 탄생과 함께 발전을 거듭하여 왔다. 근대에 들어 값싸고 풍부한 원유로부터 뽑은 성분으로 제조한 플라스틱, 수지, 섬유 등의 석유정밀화학의 발달로 인류는 풍요로운 생활을 영위하여왔다. 그러나 탄소를 주성분으로 하는 에너지원인 원유 매장량의 급감에 따른 원유가격의 급격한 상승과 대기환경오염으로 인한 지구환경의 심각한 이상 변화로 세계 경제와 정치상황이 요동치고 있다. 그리하여 탄소 이외의 원소로 구성된 청정 에너지원과 신소재의 개발이 중요과제로 대두되고 있다. 현재 우리나라를 포함한 세계 선진국들 간에 여러 첨단 기술 분야에서 고부가 기능성 신소재 개발 경쟁을 치열하게 벌이고 있으며, 이것은 곧 그 나라 존망과 직결된다. 

 소재는 크게 고분자, 금속, 세라믹으로 나눌 수 있다. 이 중에서 금속은 최근 새로운 합금에 대한 연구가 활발하게 이루어지고 있고 연성, 전성, 전도성 등이 뛰어나고 고온에도 잘 견디지만 일반적으로 무겁고, 부식되기 쉬우며 원광에서 선광, 제련까지 많은 노력과 에너지가 필요한 단점을 지닌다.
소재는 크게 고분자, 금속, 세라믹으로 나눌 수 있다. 이 중에서 금속은 최근 새로운 합금에 대한 연구가 활발하게 이루어지고 있고 연성, 전성, 전도성 등이 뛰어나고 고온에도 잘 견디지만 일반적으로 무겁고, 부식되기 쉬우며 원광에서 선광, 제련까지 많은 노력과 에너지가 필요한 단점을 지닌다.
세라믹은 열, 산화에 잘 견디고 성형이 쉬우나 무겁고 충격에 부서지기 쉽다. 고분자는 크게 유기 고분자와 무기 고분자로 나눌 수가 있고, 요사이 기능성을 갖는 무기고분자에 관한 연구가 활발하게 이루어지고 있다.
일반적으로 유기고분자는 값싸며 가볍고, 잘 산화 부식되지 않으며, 낮은 온도에서도 성형 가능하고, 우수한 전기 절연체로 작용하지만 특수한 경우 전도성을 가지기도 한다.
이러한 유기고분자의 장점에도 불구하고 몇 가지 치명적 단점을 갖고 있다. (1)극한 온도에서 사용시 경도(hardness)와 취화도(brittleness) 문제점 (2)장시간 고온 가열시 녹거나 쉽게 분해가 일어나며 인체에 해로운 독가스 배출 (3)장시간 자외선 조사시 분해 혹은 변성이 일어남 (4)유기고분자에는 없고 무기고분자에 국한된 특수 기능성 (금속성). 이러한 유기고분자가 가지는 단점을 극복하기 위해 무기고분자와 무기-유기 혼성고분자가 개발되었다. 고분자는 생성 원인별로 천연고분자 (예: 단백질, 핵산, 녹말, 셀룰로스, 키틴 등)와 인조고분자 (예: 폴리에스테르, 나일론, 폴리비닐, 폴리우레탄, 폴리카보네이트, PET, PVC 등)로 나뉘며, 용도별로 구조성 고분자와 기능성 고분자 (예: 전기발광, 광발광, 비선형광학, 액정, 생분해성, 약품전달, 분리성, 전해질, 불연성, 광분해 등)로 나눌 수 있고, 성분별로 유기고분자, 무기-유기 혼성고분자, 무기고분자로 대별된다.
1_2 무기고분자의 종류
무기고분자는 무기원소를 고분자 주사슬 또는 곁사슬에 포함하는 고분자를 일컫는다.
여기서 무기 원소는 좁게는 각종 금속 (s와 p 궤도를 채우는 알루미늄, 마그네슘과 같은 전형금속, d 궤도를 채우는 티타늄, 지르코늄, 텅스텐과 같은 전이금속, f 궤도를 채우는 란탄족-악티늄족과 같은 내부전이금속)만을 의미하지만 넓게는 비금속계 무기원소인 Si, Ge, P, B, S, O, N 등의 원소들로 골격을 이룬 것도 포함한다. 무기고분자는 다음의 세 가지 유형으로 크게 나눈다.
첫째, 무기 성분이 유기고분자의 곁사슬에 포함된 경우로서 유기고분자의 성분 성질은 거의 유지한 채 곁사슬에 포함된 무기성분의 성질 또한 나타낸다.
둘째, 무기 원소를 고분자 주사슬의 골격에 탄소와 함께 도입하거나 단독으로 도입된 경우.
셋째, 세라믹 제조를 위한 전구체 역할을 하도록 설계된 유기-무기 혼성고분자의 경우.
넷째, 순수하게 무기성분만으로 구성된 망상구조 또는 격자구조를 가지는 이온화합물의 경우가 있다. 무기 성분이 유기고분자의 곁사슬에 포함된 무기고분자의 합성에는 주로 무기성분을 치환기로 하는 비닐단위체 (vinyl monomers; CH2=CH-X 형태)가 주로 사용된다.
여기서 무기성분 치환기로서 Si(CH3)3, Si(OCH2CH3)3, SiCl3, SiH3, OSi(CH3)3, Ge(CH3)3, Sn(CH3)3, O=P(C6H5)2, phosphazene (N=P)3, borazine (BH=NH)3, metallocene (예: ferrocene), pyridine-금속 등이 있다.
이들 비닐 단위체들을 여러 가지 개시 방법(예: 라디칼 중합, 이온중합, 배위중합)을 사용하여 중합시켜 고분자를 얻는다. 주사슬에 금속계 무기성분을 가진 고분자로서 지글러-나타 올레핀 중합시 조촉매로 사용되는 methylaluminoxane (-(Me)
AlO-) 외에 금속 착물 (예: 메탈로폴피린)과 2개 배위기를 가진 리간드 (예: dipyridine)가 배위에 의해 형성된 것이 있다. 주사슬에 비금속계 무기성분을 가진 고분자로서 폴리포스파젠 (polyphosphazene; -R2P=N- 결합을 주사슬에 가짐), 폴리보라진 (polyborazine; -BH=NH- 결합을 주사슬에 가짐), 폴리실록세인 (polysiloxane; -R2Si-O- 결합을 주사슬에 가짐), 폴리실레인 (polysilane; -R2Si- 결합을 주사슬에 가짐), 폴리실라제인 (polysilazane; -R2Si-NH- 결합을 주사슬에 가짐) 등이 있다.
세라믹 제조를 위한 전구체 역할을 하도록 설계된 유기-무기 혼성고분자의 경우는 두 번째 경우에서 기술한 주사슬에 비금속계 무기성분을 가진 고분자 거의 전부가 이에 해당된다. 순수하게 무기성분만으로 구성된 이온성/산화 고분자화합물의 경우는 실리카 (SiO2), 알루미나 (Al2O3), 제올라이트 (Mx/n
[(AlO2)x.(SiO2)y].H2O), 소금 (NaCl), Zinc blende/Wurtzite (ZnS), Perovskite (CaTiO3), 형석 (CaF2), 티타니아 (TiO2), 지르코니아 (ZrO2) 등 많은 광물이 이에 해당된다. 이들 순수 무기고분자들은 촉매, 담체, 건조제, 보강재, 보석, 연마석 등 이루 헤아릴 수 없이 많은 분야에 응용된다.
1_3 세라믹 제조를 위한 전구물질로서 무기고분자의 사용
무기고분자의 많은 응용분야 중에 세라믹 전구체로의 사용이 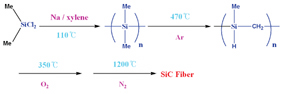 두드러진다. 세라믹의 용도는 일반 소모품에서부터 첨단 기기까지 그 응용분야가 다양하다.
두드러진다. 세라믹의 용도는 일반 소모품에서부터 첨단 기기까지 그 응용분야가 다양하다.
세라믹은 크게 산화성 세라믹과 비산화성 세라믹으로 분류된다. 규소(Silicon, Si)는 지각의 주요 구성 성분으로서 산소 다음으로 많이 존재한다. 이 규소는 자연 상태에서 여러 금속과 산소와 함께 결합하여 다양한 규산염(silicate, xM12O·ySiO2)을 형성하기도 하고, 또한 여러 전기적 양성 원소들과 직접 결합하여 이성분 화합물인 규소화합물(silicides)을 만들기도 한다. 사실 규산염의 -Si-O가 단일 결합으로 있지 않고, Si=O와 같이 이중 결합으로 있었더라면 지구, 지구자기, 중력, 대기 및 생명체는 결코 존재할 수 없었을 것이다. 본고에서는 규소와 비금속간의 이성분 화합물 세라믹 중에서 특히 비산화성 세라믹인 탄화규소(SiC)와 질화규소(Si3N4) 세라믹들의 제조 및 이들 세라믹과 금속간의 세멧(cermet) 제조에 국한하여 기술하기로 하겠다. 그 이유는 탄화규소와 질화규소 세라믹들은 고온에서 열적으로, 그리고 화학적으로 안정하고, 굳고 강도가 세므로 그 용도가 다양하기 때문이다. 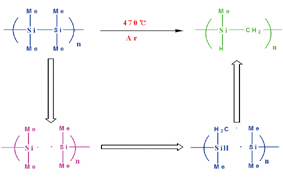
그리하여 이들 세라믹들은 우주, 항공, 선박, 자동차, 미사일 등 방산 무기체계, 전기, 전자, 제철산업, 원자로사업, 선반-건축용 기계, 스포츠 제품의 제조에 널리 쓰이고 있다. 전통적으로 SiC는 규사와 코크스를 소금, 톱밥과 함께 전기로에서 고온 반응을 일으켜 제조하며, Si3N4는 규소원소를 직접 질화시키거나 SiCl4와 NH3을 기상 또는 액상에서 반응시켜 얻는다. 이 방법으로 직접 제도된 SiC와 Si3N4는 연마제 등 대부분의 용도로서는 사용하기에 불편함이 없으나, 특별한 용도를 위해 이들 세라믹을 필름이나 섬유 형태로 제조하기 위해서는 가공하기 편리한 용해성 또는 용융성을 갖는 중간 물질을 거쳐서 고온 처리하여 제조하여야 한다. 그러므로 SiC와 Si3N4 세라믹의 제조를 위한 선구물질로서 최근에 많이 쓰이고 있는 유기규소 고분자들의 제조 및 열분해에 대해서 먼저 기술하기로 하겠다.
우선 유기규소 고분자가 적절한 선구물질이 되기 위해서는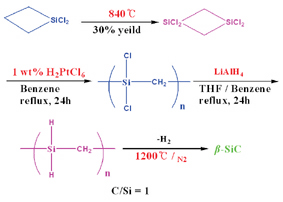 그들의 제조를 위한 원료 단위체가 값싸고 쉽게 구할 수가 있어야 하며, 분자 내 Si와 C의 조성 비율이 1:1에 가까워야 하고 중합반응의 수율이 높아야 한다.
그들의 제조를 위한 원료 단위체가 값싸고 쉽게 구할 수가 있어야 하며, 분자 내 Si와 C의 조성 비율이 1:1에 가까워야 하고 중합반응의 수율이 높아야 한다.
또한 유기규소 고분자는 가공하기 편리하도록 용해성 EH는 용융성이 커야 하며, 경제적인 이유로 고온에서 세라믹으로 변할 때 세라믹 잔여 수율이 높아야 한다. 만일 유기규소 고분자 안에 Si와 C의 조성 비율이 1:1이 아니고 Si가 더 많을 때는 Si의 용융점이 1410℃이기 때문에 고온에서 세라믹 가공에 불리하다. 한편 C가 더 많을 때는 공기 중에서 열분해 할 때 COx기체들로 방출되므로 세라믹 몸체에 균열이 가고 원래의 가공 형태가 유지되지 않는 등의 단점이 있다.
물론 유기규소 고분자 내 Si와 C의 조성 비율이 1:1이라 할지라도 많은 경우 열분해 과정 중 Si와 C중 어느 한 부분이 더 많이 제거되어, 어느 한 쪽이 과량으로 세라믹 내 잔류하게 될 수 있다. SiC와 Si3N4 세라믹은 일반적으로 1000℃ 이상의 온도에서 제조되며 결정성 SiC와 Si3N4 세라믹을 얻기 위해서는 1200~1500℃ 사이의 온도에서 열분해를 수행해야 한다. 1975년에 일본의 Yajima는 다음의 공정에 의해서 직경 18㎛ SiC 세라믹 섬유를 세계 최초로 제조하는데 성공하였다.
용융점이 97.8℃인 나트륨 (소듐, Na) 금속을 비점이 높은 비극성 방향족 xylene 용매에서 110℃ 정도로 가열하여 용융 나트륨을 제조한다.
이 용융 나트륨을 환원제로 사용하여 디메틸 디클로르실란 ((CH3)2SiCl2)을 Wurtz 짝지움 반응시켜 디메틸 규소 고분자 (polydimethylsilane, [(CH3)2Si]x)를 합성한다. 생성된 디메틸 규소 고분자는 유기 용매에 녹는 환상 저중합체와 녹지 않는 결정성의 선상 고중합체의 혼합물이다.
이 혼합물 상태의 polysilane을 아르곤 기체 분위기에서 470℃ 정도로 가열하면, 소위 Kumada 자리옮김 반응(Kumada rearrangement)에 의해 탄화규소 고분자(polycarbosilane)가 변형된다.
이 Kumada 자리옮김 반응은 규소 라디칼과 탄소 라디칼들이 매개되어 일어나는 반응이다.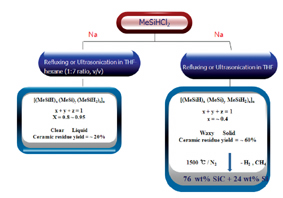
분자량 8000 정도의 이 탄화규소 고분자는 용융성과 용해성이 있고 섬유로 방추 가능하다.
다음으로 세라믹 잔여 수율을 증가시키기 위해서는, 탄화규소 고분자의 구조상으로 반응성이 큰 Si-H 결합을 고분자 주사슬에 가지고 있으므로 공기 중에서 350℃ 정도로 가열하면 산소의 작용으로 규소 간에 다리 결합을 하여 분자량이 급격히 증가되며, 마지막으로 질소 분위기에서 1200℃ 이상의 온도에서 열분해 시키면 CH4와 H2 기체를 방출하면서 SiC 세라믹이 된다. 여기에서 생성된 SiC는 일반적으로 약간 과량의 탄소가 함께 섞여 있다. 그리고 중간 물질인 탄화규소 고분자의 구조도 사실은 더 복잡하다고 알려져 있으며 또한 polysilane이 탄화규소 고분자로 변환될 때의 수율이 낮다.
이런 단점들을 보완하기 위해서 1992년에 Interrante는 값비싼 전구체를 사용하여 다음과 같은 다단계 공정을 거쳐 순수한 SiC을 얻는데 성공하였다.
이 공정은 전이금속 착물 촉매를 사용하여 환상 단위체를 개환 중합하고 곧이어 LiAH4로 환원시켜서 탄화규소 고분자를 만든 후 1200℃에서 열분해하여 높은 세라믹 수율과 높은 순도의 β-SiC를 합성하는 것이다.
Interrante는 위에 사용한 cyclosilabutane 외에 최근에 allylhydridosilane을 전구체로 사용하여 수소화규소첨가반응 (hydrosilation)을 거쳐 열분해 하므로서 순수한 SiC를 얻는데 성공하였다.
그러나 이 공정들은 다단계를 거쳐야 하고 또한 이 전구체들은 합성하기가 까다로워 값이 매우 비싸고 전략적 수출 금지 품목인 것이 단점이다. 그리하여 앞에서도 언급했듯이 유기규소 고분자 선구물질은 단위체의 값이 싸고 쉽게 구할 수가 있고 분자 내 Si와 C의 조성 비율이 1:1이며 중합 수율이 높고 반응성이 매우 큰 Si-H 결합을 가져야 하고 성형이 쉬워야 하므로 이런 조건에 부합되며 공기 중에서 발화성이 큰 polymethylsilane을 Seyferth와 Woo는 합성하였다.
 여기서 Si-H 결합은 세라믹 잔여 수율 또는 세라믹의 순도를 높이기 위해서 탈수소 가교반응 또는 수소규소화 가교반응 등의 가교반응을 위해 필요하다. 탈수소반응은 Woo-Tilley-Harrod 등에 의해 개발되었다. THF:hexane(1:7)의 혼합 용매에서 반응하여 얻어진 점성 액체 상태의 polymethylsilane의 분자량은 약 700 달톤 정도로서 약간의 가교 반응이 일어난 것이며 세라믹 잔여 수율이 1000℃에서 약 60% 정도이다.
여기서 Si-H 결합은 세라믹 잔여 수율 또는 세라믹의 순도를 높이기 위해서 탈수소 가교반응 또는 수소규소화 가교반응 등의 가교반응을 위해 필요하다. 탈수소반응은 Woo-Tilley-Harrod 등에 의해 개발되었다. THF:hexane(1:7)의 혼합 용매에서 반응하여 얻어진 점성 액체 상태의 polymethylsilane의 분자량은 약 700 달톤 정도로서 약간의 가교 반응이 일어난 것이며 세라믹 잔여 수율이 1000℃에서 약 60% 정도이다.
이들 세라믹들을 원소 분석해 보면, 76w%의 SiC와 24w%의 Si으로 구성되어 있다. 이것은 열분해 과정 중 약 1/4의 탄소 성분이 이 규소 고분자 주사슬에서 떨어져 날아간 것으로 생각할 수 있다. 그리하여 이 1/4의 탄소 성분을 이 선구물질 고분자에 붙여 두기 위해서는 유기금속 촉매를 이용한 탈수소가교반응 처리를 생각해 볼 수 있다.
이 처리 과정을 거쳐 얻어진 polymethylsilane을 써서 세라믹 잔여 수율이 1500℃에서 75%이고 98% 순도의 SiC를 얻을 수 있다. 이와 같은 가교된 polymethylsilane은 다음과 같이 기체 상태의 methylsilane의 탈수소 중합에 의해서도 가능하다.

그러나 이 방법은 MeSiH3가 기체여서 다루기가 힘들고, 생성된 유기규소 고분자가 잘 녹지 않는 단점이 있다.
반응성이 큰 Si-H기가 있는 polymethysilane과 비닐기가 있는 polysilyacetylene과 적절한 비율(1:6)로 혼합한 후 AIBN 라디칼 개시제를 촉매로 하여 수소화 규소 첨가반응을 시켜 하이브리드를 형성한 후 열분해하면 순수한 SiC를 얻을 수가 있다.
Polymethylsilane은 그 자체가 열분해시 76wt%의 SiC와 24wt%의 Si를 주고 polysilyacetylene은 50wt%의 SiC와 50wt%의 C를 주므로 적절한 비율로 섞어 결합시킨 혼성체(hydrid)를 만들어 순수한 SiC 제조를 위한 선구 물질로 사용 가능한 예라 하겠다. 한편 polymethylsilane은 꽤 공기 중에서 발화성이 크고 반응성이 크므로 그보다 반응성이 작은 주쇄가 탄소로 이루어진 poly(vinylsilane)도 선구물질로 가능하겠다. Polyvinylsilane, [CH2CH(SiH3)]n은 [CH2CH(SiX3)]n (X=Cl, OR)을 LiAlH4로 환원시켜 만들며, 이 실란 자체를 1500℃에서 열분해하면 39% 세라믹 잔여 수율로 94wt% SiC와 6wt% C가 얻어진다. 이 경우 4족 전이금속 촉매를 써서 탈수소 가교 반응 처리를 하면 80%로 세라믹 잔여 수율은 증가하지만, 순도는 89% SiC로  오히려 떨어진다.
오히려 떨어진다.
Polymethylsilane과 poly(vinylsilane)은 자체 열분해 시 각기 25wt% Si와 6wt%의 C가 SiC와 함께 얻어지므로 이들 고분자들과 전이금속 분말 또는 전이금속 산화물 분말과 적절한 비율로 섞거나, 유기금속 착물들과 섞어서 혼성체를 만든 후 열분해하면 무기물과 금속의 혼합 세라믹인 cermet (세멧)을 제조할 수 있다. 예를 들면, poly(vinylsilane)과 티타늄(Ti) 금속 분말을 섞은 후 1500℃ 아르곤 분위기에서 열분해하면 TiC와 SiC가 3:2 비율로 섞인 세멧이 형성되며, 1000℃ 암모니아 분위기에서 열분해하면 TiN과 SiC가 4:1로 섞인 세멧이 형성된다. 이들은 다양한 공구의 제조나 고온 고상 촉매로 쓰일 수가 있다. 이외에도 다양한 전이금속 분말들과 여러 유기규소 고분자들을 다양한 비율로 혼합한 후 열분해하면 주위 기체의 종류에 따라서 여러 다른 다양한 세멧을 제조할 수가 있다. 한편 polysilane을 탄화규소 고분자로 변형시켜서 열분해하면 총 세라믹 잔여 수율이 떨어지고, 중간물질인 탄화규소 고분자의 구조도 정확히 알 수가 없으므로, polysilane보다는 구조를 정확히 알고 있는 탄화규소 고분자를 합성한 후 열분해하여 세라믹 잔여 수율도 올리고 순수한 SiC을 제조하려는 시도가 있다. 예를 들면, MeSiH2CH2CH2SiH3을 (C5H5)2TiMe2촉매로 상온에서 중합시키면, 입체 장해가 적은 일차 실란기인 말단의 SiH3기가 먼저 수소를 방출하면서 용매에 녹는 분자량 1000 달톤 정도의 저 중합체를 형성하며, 시간이 갈수록 그리고 온도를 올릴수록 이차 실란기인 MeSiH2기가 중합이 또한 진행되어 가교 반응이 일어나게 된다. 이 최종 중합물을 1200℃에서 열분해하면 73%의 세라믹 잔여 수율로 거의 99% 순도의 SiC가 생성된다.
다음으로 Si3N4 세라믹의 제조에 관해서 간단히 기술하겠다. Si3N4 는 polymethylsilane을 암모니아 분위기에서 열분해해서 제조할 수도 있고, polymethylsilazane 선구물질을 제조한 수 열분해해서 제조할 수도 있다.
Polymethylsilazane은 MeSiHCl2와 NH3을 ether 용매에서 반응시켜 합성하는데 생성된 polymethylsilazane의 세라믹 잔여 수율을 높이기 위해서 KH 또는 (C5H5)2TiR2 등으로 가교시킨다. 이런 처리를 한 후 열분해하면 Si3N4가 생성되며 또는 금속 분말과 섞어서 열분해하면 Si3N4와 전이금속 질화물이 혼합된 세멧이 생성된다.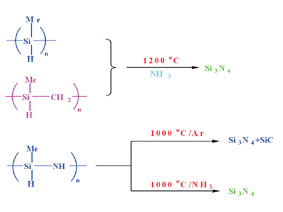
결론
신소재(고분자, 금속, 세라믹)는 기존의 재료와는 다른 우수한 특성과 새로운 기능이 있어 우리 인류 복지에 매우 중요하며 우리는 무한대 생존 경쟁에 몰리고 있다. 이 중 무기고분자는 유기고분자의 단점을 보완하는 동시에 새로운 기능성을 가지므로 산업발전에 매우 중요하다. 다양한 무기고분자의 응용분야 중 세라믹 전구체로의 사용은 첨단 산업 분야에 막대한 발전을 초래하였다. 특히 규소를 함유하는 비산화성 세라믹인 탄화규소 (SiC) 및 질화규소 (Si3N4) 세라믹은 그 산업적 용도가 다양하다. 규소 고분자는 원료 물질이 값싸고 중합 수율이 높아서 경제적이고, 분자 내 Si와 C 또는 N의 비율을 자유자제로 조정할 수가 있고, 용융성 또는 용해성이 있으므로 성형가공이 가능하며, 세라믹 잔여 수율을 증대시키기 위해서 여러 화학반응에 의해 가교도 시킬 수가 있다. 열분해 조건에 따라서 SiC와 Si3N4 등 선택의 조절이 쉬우며, 금속과 섞어서 열분해 함으로서 세멧도 제조할 수가 있다. 이런 종류의 연구는 신소재의 총아인 금속, 고분자, 세라믹 연구들이 함께 어우러진 종합 작품이라 할 수 있겠다. 여러 유형의 유기규소 고분자들을 다양하게 합성해서 그 열분해 과정을 좀 더 면밀히 연구한다면 산업적 응용 가능성은 매우 크리라 기대된다. 끝으로 KICOS를 통한 과기부의 연구비(K20602000009-07E0200-00910) 지원에 대해 감사드린다.
그림 1. 첨단 신소재 기술로 제조된 최신 기기 : 국산 탱크, 국산 자기부상열차, 영국제 핵잠수함
그림 2. SiC 세라믹 섬유의 제조를 위한 Yajima 공정
그림 3. Kumada 자리옮김 반응에 의한 규소고분자의 탄화규소고분자로의 변형
그림 4. 고순도 SiC 세라믹을 얻기 위한 Interrante 공정
그림 5. Wurtz 짝지움반응에 의한 polymethylsilane 저중합체의 합성
그림 6. 전이금속 4족 촉매에 의한 polymethylsilane의 탈수소짝지움
가교처리 후 열분해 반응 공정
그림 7. 전이금속 4족 촉매에 의한 MeSiH3의 탈수소중합반응과 열분해 반응 공정
그림 8. 수소화규소첨가반응에 의한 고분자 혼성체 제조 및 열분해 반응 공정
그림 9. 질화규소 세라믹 및 복합물의 제조공정
 김명희
김명희
광주여자대학교 환경보건학과 이학사조선대학교
환경교육학과 교육학석사
전남대학교 화학과 박사과정 재학 중 / 나노기술연구센터 연구원
 조명식
조명식
서남대학교 화학과 이학사
전남대학교 화학과 이학석사
전남대학교 화학과 이학박사
광주지방식품의약품안전청 시험분석팀 보건연구사
 우희권
우희권
연세대학교 화학과 이학사
KAIST 화학과 이학석사
Harvard 대학교 이학석사
캘리포니아대학교 (U. C. San Diego) 화학과 이학박사
M.I.T. 공과대학교 화학과 박사후연구원
McGill 대학교 화학과 박사후연구원
전남대학교 화학과(알란 멕디아마드 에너지연구센터 및 나노기술연구센터) 교수
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net