고온 수소분리용 다공성 세라믹 멤브레인 개발
김영희 요업(세라믹)기술원 세라믹건재본부 책임연구원
김수룡 요업(세라믹)기술원 세라믹건재본부 수석연구원
류도형 요업(세라믹)기술원 나노소재응용본부 책임연구원
권우택 요업(세라믹)기술원 세라믹건재본부 책임연구원
1. 고온 수소분리용 다공성 멤브레인 개요
화석연료의 사용에 따른 지구온난화와 원유자원의 고갈로 화석연료의 경제성은 2020년에 급격히 나빠질 것으로 예상되며 따라서 미국, 일본 등 여러 선진국가의 정부는 2020년까지 수소 경제로의 전환을 목표로 수소 연구 개발에 집중 투자 하고 있다. 수소는 석유화학공업, 전자산업분야의 수요도 많으나 현재는 에너지와 자원을 대량으로 소비하는 종래의 기술로부터 탈피하여 적은 자원으로 높은 에너지 효율을 발휘하는 연료전지의 저공해 에너지원으로서 각광을 받고 있다. 연료전지용 리포머(연료개질기) 기술은 연료전지 스택 운전에 필수적인 수소생산 및 공급 시스템 기술로서 고효율화를 위한 소형화, 경량화 등의 기술 개발이 필수적으로. 미국 일본 등 선진 각국에서 리포머 설계 관련 핵심요소 및 컴팩트화를 위한 엔지니어링 기술 개발이 활발히 진행되고 있는 가운데, 연료전지용 리포머에서 반응과 동시에 고온에서 수소를 분리하기위한 핵심부품인 세라믹 멤브레인을 개발하기 위하여 미국의 DOE, 일본의 NEDO, 그리고 유럽의 LUCADI등을 중심으로 활발히 연구가 진행되고 있다.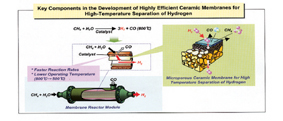
천연가스의 주성분은 CH4이고, 석유에 비하여 풍부한 매장량을 가지고 있으므로 가까운 장래의 에너지원으로 주목받고 있으며, 촉매, 스팀 존재하에서 500℃~800℃의 고온에서 아래 반응에 의하여 수소가스와 CO를 생산하게 된다.
CH4 + H2O --Catalyst, 500- 800℃----> H2 + CO
이 반응에 고온수소분리용 세라믹 멤브레인을 사용하게 되면 반응과 동시에 고온에서 수소분리가 가능하고 반응물인 수소의 분리는 반응의 진행을 용이하게 하여 전체 반응의 효율을 증가 시킨다. 현재 수소 분리막으로는 고분자막 또는 Pt, Pd 등의 dense한 막이 주로 사용되고 있으나, 고분자막은 150℃이상에서는 사용이 불가능하며 Pt, Pd 등 귀금속 막은 고가이면서도 CO 또는 Sulfur 존재하에서는 피독되어 기능을 상실하는 단점을 가지고 있다. 500℃이상의 고온에서 반응과 동시에 고온에서 수소를 분리하기 위하여 amorphous silica, Zeolite, nanoporous SiC 그리고 nanoporous Si3N4 membrane등이 연구되어지고 있다. 다공성 세라믹막인 경우에는 surface 또는 Knudsen diffusion등 molecular diffusion에 의해 수소를 분리하므로 기공의 미세구조에 큰 영향을 받아 기공의 크기 및 형태가 수소에 대한 선택도, 투과도 등에 변화를 초래하게 된다.
2. 국내외 기술 개발동향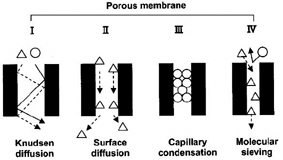
일본의 경우 1970년대 이후 많은 연구가 진행되었으며 대학과 연구소에서 CVD, Sol-gel, 열수성법 등을 이용한, Silicate, Zeolite, Metal Oxide막 제조와 Palladium 합금막을 이용한 수소정제와 막 반응기, Zirconia(YSZ)와 perovskites 산소이온 투과막에 의한 부분산화에 의한 경제적인 합성가스 제조 연구 등과, 이밖에 탄소 막, Metal alloy막 등 다양한 종류의 막과 이를 이용한 막 반응기 연구를 활발히 진행하고 있어 세계적으로 이 분야의 선두 그룹을 이루고 있으며, 미국의 Oak Ridge Lab.에서도 고온 수소분리를 위한 세라믹 멤브레인에 관한 많은 연구가 진행되어 지고 있다. 일본 NGK사에서는 세라믹 다공질 지지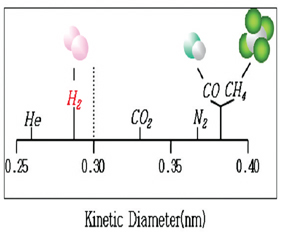 체의 표면에 금속 Pd 합금을 박막화한 멤브레인 필터를 제안하여 고효율 수소가스 정제용 멤브레인 분리기를 개발생산하고 있으며 일본 미쓰비시 중공업에서는 탄화수소 개질용 촉매와 수소 분리막을 이용한 고순도 수소제조장치에 대한 연구개발을 진행 중이다.
체의 표면에 금속 Pd 합금을 박막화한 멤브레인 필터를 제안하여 고효율 수소가스 정제용 멤브레인 분리기를 개발생산하고 있으며 일본 미쓰비시 중공업에서는 탄화수소 개질용 촉매와 수소 분리막을 이용한 고순도 수소제조장치에 대한 연구개발을 진행 중이다.
미국에서는 DOE 주도로 다양한 용도와 형태의 분리막 반응기를 개발하고 있으며, 세라믹 멤브레인을 이용한 고순도 기체 제조 장치를 개발하고 있고 미국의 MRT Technology사에서는 세라믹 멤브레인을 이용하여 메탄가스로부터 99.99%의 수소를 생산할 수 있는 반응공정을 상업화하였다.
국내의 경우 화학연구원에서는 87년부터 분리막 제조와 분리특성을 연구하여 왔으며 다양한 종류의 분리막을 개발하였고 수소분리막에 관한 연구는 한양대학교를 중심으로 실리카/다공질 탄소 복합체를 이용한 중공사형 수소 분리막 모듈을 개발하고 있으며 요업기술원에서는 고순도 수소 제조용 치밀질 바륨세라이트계 세라믹 멤브레인을 개발하고 있다.
 3. 고온 수소분리용 다공성 멤브레인 제조
3. 고온 수소분리용 다공성 멤브레인 제조
IUPAC의 정의에 따르면 2nm보다 작은 기공크기를 갖는 amorphous silica 또는 Zeolite membranes등 무기막을 Microporous membrane이라고 부르며 이 경우에는 그림 2에서 보여지는바와 같이 Molecular sieving, Capillary condensation 그리고 Surface diffusion등의 투과 메카니즘에 따라 기공을 통해 기체의 투과가 이루어진다. 일반적으로 Microporous porous membrane을 통한 수소의 투과속도는 10-6~10-7mole/m2.S.Pa 정도이며 압력에 비례한다.
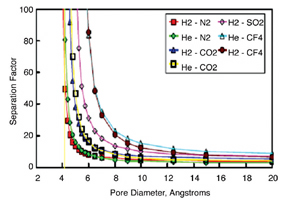
그림 3에서는 computer simulation으로 부터 기공 크기에 따라 기체들간의 선택도를 보여 주고 있다. 이 결과에 의하면 기공의 크기를 0.5nm 이하로 줄여야 수소선택도가 급증하는 것을 볼 수 있다. 하지만 기공크기를 줄여 선택도를 증가시키면 기체 투과도가 줄어들게 된다. 세라믹 분리막만을 이용하여 100% 수소 분리는 불가능하기 때문에 Pressure Swing Adsorption (PSA) 방법과 상호 보완하여 사용하게 되면 에너지 절약 측면과 효율측면에서 바람직하다.
가. 제올라이트와 실리카 멤브레인 제조
제올라이트는 일반적으로 그 결정 내부에 존재하는 특이한 세공구조때문에 산업적으로 유용한 각종 물리화학적 특성을 갖는 천연 및 합성 광물질을 일컫는다.
현재 46종의 천연 제올라이트와 200여종의 합성 제올라이트가 알려져 있다. 이들은 결정 구조, 화학 조성, 및 물리화학적 특성 면에서 서로 다르지만, 주변 조건에 따라 그 구조 내에 분자들이 쉽게 드나들 수 있을 만큼 큰 공간을 형성한다는 공통적인 특징이 있다. (그림 4a) 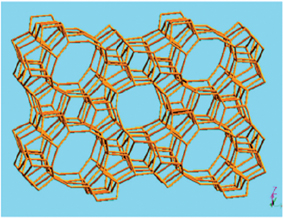
.jpg) 일반적으로 제올라이트는 구조상의 공동 내에 많은 양의 물 (10~15wt%)을 함유하지만, 200~300℃로 몇 시간 가열하면 쉽게 탈수된다. 이 탈수된 제올라이트는 적합한 크기와 형태의 무기 및 유기 분자들을 선택적으로 흡착함으로써, 결과적으로 서로 섞여 있는 다른 분자들을 각각 분리할 수 있는 뛰어난 분자체 기능 (molecular sieving)의 특성을 갖게 된다. 이와 같은 분자체 기능에 연관된 제올라이트의 선택적 분리 특성은 제올라이트 공동의 크기와 형태에 따라 다른 양상을 보인다. 예를 들어, 합성 제올라이트인 zeolite A, X, MFI등의 경우 0.3nm~0.6nm 정도의 기공 크기를 보인다.
일반적으로 제올라이트는 구조상의 공동 내에 많은 양의 물 (10~15wt%)을 함유하지만, 200~300℃로 몇 시간 가열하면 쉽게 탈수된다. 이 탈수된 제올라이트는 적합한 크기와 형태의 무기 및 유기 분자들을 선택적으로 흡착함으로써, 결과적으로 서로 섞여 있는 다른 분자들을 각각 분리할 수 있는 뛰어난 분자체 기능 (molecular sieving)의 특성을 갖게 된다. 이와 같은 분자체 기능에 연관된 제올라이트의 선택적 분리 특성은 제올라이트 공동의 크기와 형태에 따라 다른 양상을 보인다. 예를 들어, 합성 제올라이트인 zeolite A, X, MFI등의 경우 0.3nm~0.6nm 정도의 기공 크기를 보인다.
제올라이트 합성은 반응성이 큰 “aluminosilicate gel”로부터 수열 합성 (hydrothermal synthesis)하는 방식으로 합성된 제올라이트의 종류는 출발 물질의 종류 및 Si/Al의 함유 정도, 알칼리 용액의 농도, 처리 온도, 
 숙성 시간 등에 따라 달라진다. 제올라이트 멤브레인의 합성은 일반적으로 다공성 알루미나 또는 스테인레스 스틸을 지지체로 하여 만들어 지며 제올라이트 합성시 수열합성반응기에 지지체를 담구어 반응함으로써 멤브레인을 얻는다. 그림 4b에서 보는바와 같이 지지체는 점차적으로 기공크기를 줄이기 위하여 처음에는 100nm정도의 기공을 갖는 α-알루미나를 사용하고 그위에 γ-알루미나 sol을 사용하여 코팅한 후 500℃~600℃에서 열처리하여 기공크기를 4~10nm로 줄인 후 0.5nm정도 크기의 제올라이트 멤브레인을 형성 시킨다.
숙성 시간 등에 따라 달라진다. 제올라이트 멤브레인의 합성은 일반적으로 다공성 알루미나 또는 스테인레스 스틸을 지지체로 하여 만들어 지며 제올라이트 합성시 수열합성반응기에 지지체를 담구어 반응함으로써 멤브레인을 얻는다. 그림 4b에서 보는바와 같이 지지체는 점차적으로 기공크기를 줄이기 위하여 처음에는 100nm정도의 기공을 갖는 α-알루미나를 사용하고 그위에 γ-알루미나 sol을 사용하여 코팅한 후 500℃~600℃에서 열처리하여 기공크기를 4~10nm로 줄인 후 0.5nm정도 크기의 제올라이트 멤브레인을 형성 시킨다.
4. 나노다공성 SiC 멤브레인 제조
미국의 DOE를 중심으로 천연가스 리포밍공정에 사용될 수 있는 산소 및 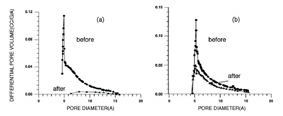 수소 투과막의 소재로 perovskite type의 이온 전도성 세라믹막에 관한 연구가 이루어지고 있으나 수소 및 산소 투과도가 아직은 낮은 실정이며 일본의 NEDO는 5개년 project로 고온 수소분리를 위하여 다공성 알루미나 지지체위에 내열 내산화성 등 고온 특성이 우수한 SiC nanoporous 멤브레인을 제조하는 연구를 ‘R&D Project on Highly Efficient Ceramic Membranes for High-Temperature Separation of Hydrogen’라는 제목으로 2002년부터 시작되어 수행하고 있다. 이 project의 주 내용으로는 amorphous SiC, SiCBN, SiMO, ZrMO등의 세라믹 멤브레인을 sol-gel, polymer pyrolysis, CVD방법으로 500℃ 이상의 고온에서 1×10-6 mol/m2.s.Pa (Pd 멤브레인 대비 10%~20%)의 투과도를 갖는 세라믹 막을 제조하고 모듈화하여 천연가스의 스팀 리포밍에 의한 수소제조 및 분리반응에 적용하여
수소 투과막의 소재로 perovskite type의 이온 전도성 세라믹막에 관한 연구가 이루어지고 있으나 수소 및 산소 투과도가 아직은 낮은 실정이며 일본의 NEDO는 5개년 project로 고온 수소분리를 위하여 다공성 알루미나 지지체위에 내열 내산화성 등 고온 특성이 우수한 SiC nanoporous 멤브레인을 제조하는 연구를 ‘R&D Project on Highly Efficient Ceramic Membranes for High-Temperature Separation of Hydrogen’라는 제목으로 2002년부터 시작되어 수행하고 있다. 이 project의 주 내용으로는 amorphous SiC, SiCBN, SiMO, ZrMO등의 세라믹 멤브레인을 sol-gel, polymer pyrolysis, CVD방법으로 500℃ 이상의 고온에서 1×10-6 mol/m2.s.Pa (Pd 멤브레인 대비 10%~20%)의 투과도를 갖는 세라믹 막을 제조하고 모듈화하여 천연가스의 스팀 리포밍에 의한 수소제조 및 분리반응에 적용하여 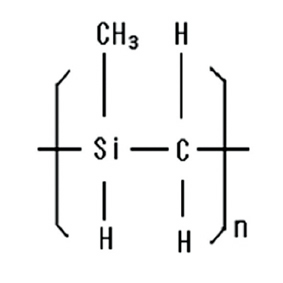
 Hydrogen fuel station, 연료전지의 소형 리포머, 석유화학산업의 고효율화 등에 응용하는 것이다.
Hydrogen fuel station, 연료전지의 소형 리포머, 석유화학산업의 고효율화 등에 응용하는 것이다.
Amorphous silica, Zeolite membrane등의 다공성 세라믹 분리막은 수소를 선택적으로 투과하나 고온, 스팀 존재하에서는 막이 급격히 불안정하게 되어 선택도, 투과도 등에 변화를 초래한다. 이같은 이유는 다공성 세라믹막인 경우에는 surface 또는 Knudsen diffusion등 molecular diffusion에 의해 수소를 분리하므로 기공의 미세구조에 큰 영향을 받아 Amorphous silica, Zeolite membrane, γ-Al2O3 등 세라믹막은 고온, 스팀 존재하에서 기공의 크기 및 형태가 변화되어 수소에 대한 선택도, 투과도 등에 변화를 초래하기 때문이다.
실리콘카아바이드는 강한 공유 결합성 화합물로 고온, 스팀 존재하에서도 구조가 변하지 않는 장점을 가지고 있어 고온 수소 분리막으로 일본의 도쿄대학, 미국의 Oak Ridge Lab.등을 중심으로 많은 연구가 진행되어 지고 있으며 국내에서도 요업기술원, 화학연구소 등에서 연구가 진행되고 있다.
SiC 멤브레인의 합성 역시 다공성 알루미나 또는 스테인레스 스틸을 지지체로 하여 만들어 지며 지지체는 점차적으로 기공크기를 줄이기 위하여 처음에는 100nm정도의 기공을 갖는 α-알루미나를 사용하고 그위에 γ-알루미나 sol을 사용하여 코팅한 후 500℃~600℃에서 열처리하여 기공크기를 4~10nm로 줄인 후 0.5nm~1nm정도 크기의 SiC 멤브레인을 형성 시킨다.
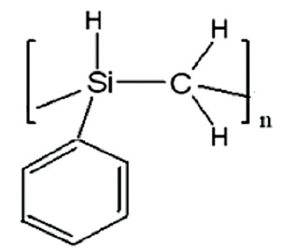
SiC 멤브레인은 Methyltrichlorosilane 또는 Triisopro
pylsilane을 organic precursor로 하여 700℃~800℃에서 Chemical Vapor Deposition방법으로 만들어 지거나 또는 유기용매에 잘녹는 SiC Preceramic precursor인 Polycarbosilane 또는 Polyphenylcarbosilane을 사용하여 spin 또는 dip coating한 후 질소 분위기에서 700℃~800℃로 열처리 한 후 사용한다. (그림 7)
5. 결론
천연가스로부터 수소 제조시 고온수소분리용 세라믹 멤브레인을 사용하게 되면 반응과 동시에 고온에서 수소분리가 가능하고 반응물인 수소의 분리는 반응의 진행을 용이하게 하여 전체 반응의 효율을 증가 시킨다.
현재 수소 분리막으로는 고분자막 또는 Pt, Pd 등의 dense한 막이 주로 사용되고 있으나, 고분자막은 150℃이상에서는 사용이 불가능하며 Pt, Pd 등 귀금속 막은 고가이면서도 CO 또는 Sulfur 존재하에서는 피독되어 기능을 상실하는 단점을 가지고 있다. 500℃이상의 고온에서 천연가스로부터 수소 제조 반응과 동시에 고온에서 수소를 분리하기 위하여 또한 석탄의 가스화반응 (IGCC)으로부터 고온에서 직접 수소를 효율적으로 분리하기 위하여 amorphous silica, Zeolite, nanoporous SiC등의 세라믹 멤브레인이 국내외 적으로 많은 관심의 대상이 되고 있다.
세라믹 분리막을 사용하여 기체를 분리하는 경우 기공의 크기를 0.5nm이하로 줄여야 수소 투과 선택도가 급증하는 것을 볼 수 있다. 하지만 기공크기를 줄여 수소선택도를 증가시키면 기체 투과도가 줄어들게 되는 문제점이 있으며 세라믹 분리막만을 이용하여 100% 수소 분리는 불가능하기 때문에 Pressure Swing Adsorption (PSA) 방법과 상호 보완하여 사용하게 되면 에너지 절약 측면과 효율측면에서 바람직하다.
참고문헌
1. Permselectivity of a nickel/ceramic composite membrane at elevated temperatures: A new prospect in hydrogen separation. Journal of Membrane Science, Vol 288, No 1-2, P208-217, (2007) B. Ernst, S. Haag and M. Burgard
2. A novel system of Al100P60Oz microporous ceramic membrane for hydrogen separation from hydrogen/propane mixtures. Microporous and Mesoporous Materials,Vol 99, No 1-2, P176-180, (2007) S.D. Sklari and V.T. Zaspalis
3. Pure nickel coating on a mesoporous alumina membrane: Preparation by electroless plating and characterization. Surface and Coatings Technology, Vol 201, No 6 P2166-2173 (2006) S. Haag, M. Burgard and B. Ernst
4. Hydrogen separation by dense cermet membranes. Fuel, Vol 85, No 2, P150-155 (2006) U. Balachandran, T.H. Lee, L. Chen, S.J. Song, J.J. Picciolo and S.E. Dorris
5. Development of tubular substrates, silica based membranes and membrane modules for hydrogen separation at high temperature. Journal of Membrane Science, Vol 267, No 1-2, P8-17 (2005) Y. Yoshino, T. Suzuki, B.N. Nair, H. Taguchi and N. Itoh
6. Hydrogen separation through the use of mixed oxygen ion and electron conducting membranes (I): theoretical analysis. International Journal of Hydrogen Energy, Vol 29, No 15, P1623-1629 (2004) S. Gopalan and C. Hengdong
7. Current status of dense ceramic membranes for hydrogen separation: Proceedings of the International Technical Conference on Coal Utilization & Fuel Systems, Vol 2, No 27, P1155?1165 (2002), U. Balachandran
8. Microporous and dense inorganic membranes: current status and prospective Separation and Purification Technology, Vol 25, No 1-3,P39-55 (2001) Y. S. Lin
9. Template-removal-associated microstructural development of porous-ceramic-supported MFI zeolite membranes. Microporous and Mesoporous Materials,Vol 34, No 3, P241-253 (2000) J. Dong, Y. S. Lin, Michael Z. -C. Hu, R. A. Peascoe and E. A. Payzant
10. Hydrogen purification of thermochemically decomposed gas using zirconia-silica composite membrane. International Journal of Hydrogen Energy, Vol 19, No 6, P517-521 (1994) H. Ohya, T. Hisamatsu, S. Sato and Y. Negishi
11. Laser synthesis of palladium alumina composite membranes for production of high purity hydrogen fom gasification. Applied Surface Science, Vol 253, P 1247-1254 (2006), B. Singh, A.C. Sheth, N. B. Dahotre
12. The project brochure of “R & D Project on Highly Efficient Ceramic Membranes for High-Temperature Separation of Hydrogen? NEDO, Japan
13. Oak Ridge Lab. report ?evelopment of inorganic membrane for hydrogen separation?B.L. Bischoff, R.R. Judkins, K.D. Adcock and L.E. Powell
Fig 1. Small scale reformer using a ceramic membrane12)
(a) (b)
Fig 2. (a) Mechanisms of gas transport in ceramic membranes. (I) In Knudsen diffusion, the gas collides more frequently with the pore wall than with other gas molecules. (II) In surface diffusion, the gas adsorbs onto the surface and then diffuses along the pore surface by activated jumps. (III)In capillary condensation, the interaction between the penetrant and the pore walls causes condensation, which influences diffusion through the pore. (IV) In molecular-sieving pores, the size of the pore prevents larger molecules from passing. (b) The Kinetic diameters of various molecules.
Fig 3. Separation factors for gas pairs with different relative sizes as a function of the pore diameter obtained by using the Hard Sphere Transport Model13)
(a) (b)
Fig 4. (a) MFI structure of Zeolite
(b) Membrane substrate having gradual pore size distribution
(a) (b)
Fig 5. (a) SEM images of the zeolite membranes on α-alumina support (a) surface (b) cross-sectional.
Fig 6. Pore size distributions of (a) pure silica membrane (b) 3% Al doped silica membrane before and after exposure to air at 600℃ for 30 h.8)
(a) (b)
Fig 7. The structure of (a) Polycarbosilane (b) Polyphenylcarbosilane
 김영희
김영희
고려대학교 화학과 학사, 석사
Polytechnic University of New York 박사
현재 요업(세라믹)기술원 세라믹.건재본부 책임연구원
 김수룡
김수룡
한양대학교 요업공학과 학사
서울대학교 무기재료공학과 석사, 박사
현재 요업(세라믹)기술원 세라믹.건재본부 수석연구원
 류도형
류도형
서울대학교 무기재료공학과 학사, 석사, 박사
현재 요업(세라믹)기술원 나노소재응용본부 책임연구원
 권우택
권우택
아주대학교 화학공학과 학사
한양대학교 화학공학과 석사
현재 요업(세라믹)기술원 세라믹.건재본부 책임연구원
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net