지구환경보전과 나노기공 세라믹 소재의 응용
박재구 한양대학교 공과대학 자원환경공학과 교수
1. 서론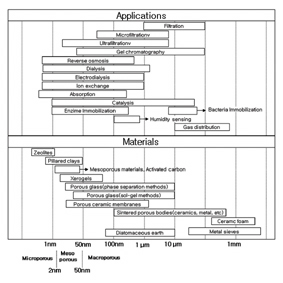
웰빙으로 표현되는 삶의 질이 중요시되면서 일반인들의 환경에 대한 관심 또한 날로 높아지고 있다. 최근의 환경기술은 환경오염물의 다양화 및 규제강화에 따라 점점 고도화되고 있으며, 공정기술 뿐만 아니라 오염물 제거를 위한 소재개발등 융합기술(Fusion technology)의 중요성이 대두되고 있다. 따라서 지구환경보전을 위해서는 입자상 및 가스상의 각종 오염물을 제거해야 하며 이에는 미세 기공구조를 갖는 필터, 흡착재 등의 나노구조 환경소재(environmental nano materials)가 중요한 역할을 한다. 이러한 환경소재에 의한 오염입자의 제거메커니즘은 기공내의 particle trapping이 되므로 기공크기가 매우 주요한 인자가 된다. 한편 환경소재의 출발물질로는 내열성, 내구성 측면에서 우수한 세라믹 제품이 대기 및 수처리용으로 폭넓게 응용되고 있으며, 기공은 크기에 따라 macropore, mesopore 그리고 micropore로 분류되고 있다. 본고에서는 이들 기공크기에 따른 나노 세라믹 소재의 대표적인 응용 예를 소개하고자 한다.
2. 기공성 세라믹의 분류 및 응용
기공 크기에 따른 기공성 소재의 분류는 IUPAC (The International Union of Pure Applied Chemistry)에서 기본적으로 크게 세 범위로 나누었다. 기공 크기가 2nm 보다 작은 물질은 microporous 물질, 2~50nm 사이의 기공 크기를 갖는 물질은 mesoporous 그리고 50nm 이상의 물질은 macroporous라고 분류하였다[1].
필터의 경우에는 제거 대상의 입자크기에 따라 microfiltration(입자지름: 0.1~10㎛), ultrafiltration (입자지름: 1~100nm)로 분류되며 이온교환법 또는 역삼투압의 경우에는 10Å이내인 이온 및 분자가 처리대상입자가 된다. Fig. 1은 기공 크기가 따른 세라믹 소재의 다양한 용도를 나타낸 것이다.
2.1 매크로 포어(> 50nm) 소재
매크로 기공크기는 50nm 이상의 크기인 다공성 물질을 말한다. Fig 2는 입자상 물질 처리용 필터의 미세구조 사진이다. 사진에서 보듯이 표면 여과층의 기공은 수 ㎛이하로 조절되어 있으며, 내부지지층에서는 150~200㎛으로 조절되어 있다.
즉 표면층의 미세입자 여과기능과 지지층에서의 높은 투과율을 유지하기 위해 필터는 일반적으로 이중 기공구조로 제조된다. 이 때 지지층의 기공구조를 연속성 열린 기공으로 하는 경우에는 필터로 인한 유체의 압력손실을 줄일 수 있다[2].
이와 같이 매크로 기공크기의 벌크상 소재는 유체의 투과성이 우수하고 내구성이 뛰어나므로 지지체(support)로 폭넓게 활용되고 있다[3]. Fig. 3은 고상 발포법(좌) 및 액상 발포법(우)으로 제조된 대표적인 매크로 기공을 가지는 기공성 세라믹 지지체의 내부 구조를 나타낸 것이다.
2.2 메조 포어(2~50nm) 소재
메조기공 물질은 1992년에 Mobile사의 연구진에 의하여 M41S군(M41S family)이라고 명명된 일련의 메조포러스 물질인 MCM-41과 MCM-48의 합성이 발표되었다[5]. 이들 물질들은 Fig. 4의 전자현미경의 사진으로 보듯이 기공의 크기가 나노미터 수준으로 매우 균일하고 마치 배열의 규칙이 벌집을 보듯 일정한 것으로 알 수 있다. 또한, 나노기공의 크기를 합성조건에 따라 1nm에서 30nm까지 정밀하게 조절할 수 있다는 장점을 갖고 있다. 한편 급격한 산업화와 인구증가로 인하여 환경오염 문제가 발생되고 있으며, 농토, 하천 및 연안해역의 오염으로 인간의 건강보호 및 생활환경의 위험이 심각한 사회적 문제로 대두되고 있다. 특히, 중독성 중금속은 지속성이 커서 자연환경에 노출되면 그 양이 미량일지라도 생물체에 농축되고 먹이사슬에 의하여 인체에 축적되어 급만성적 중독현상이 나타난다.
한편 급격한 산업화와 인구증가로 인하여 환경오염 문제가 발생되고 있으며, 농토, 하천 및 연안해역의 오염으로 인간의 건강보호 및 생활환경의 위험이 심각한 사회적 문제로 대두되고 있다. 특히, 중독성 중금속은 지속성이 커서 자연환경에 노출되면 그 양이 미량일지라도 생물체에 농축되고 먹이사슬에 의하여 인체에 축적되어 급만성적 중독현상이 나타난다.
이러한, 유독성 중금속을 처리하기 위해 여러 방법으로 중금속을 제어하고자 하는 연구가 이루어지고 있다. 처리법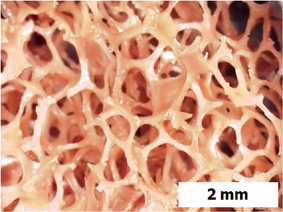 은 이온교환법(Ion exchange), 흡착법, 침전법 등이 가장 대표적인 방법으로 사용되고 있다. 최근 미생물을 이용한 중금속 제거, 즉 생물학적 복원(Bioremdiation)도 있다[4]. 이러한 기술 중에서 흡착법은 유체상의 특성 성분들을 고체 흡착제의 표면에 부착시켜 분리시키는 분리공정의 하나로서, 일반적으로 혼합물 내에 존재하는 원하지 않는 물질의 분리제거를 목적으로 사용되고 있다.
은 이온교환법(Ion exchange), 흡착법, 침전법 등이 가장 대표적인 방법으로 사용되고 있다. 최근 미생물을 이용한 중금속 제거, 즉 생물학적 복원(Bioremdiation)도 있다[4]. 이러한 기술 중에서 흡착법은 유체상의 특성 성분들을 고체 흡착제의 표면에 부착시켜 분리시키는 분리공정의 하나로서, 일반적으로 혼합물 내에 존재하는 원하지 않는 물질의 분리제거를 목적으로 사용되고 있다.
여러 가지의 중금속 제거 공정 중에서 흡착공정이 가지는 이점은 높은 제거효율과 낮은 에너지 비용을 들 수 있으며, 분리하고자 하는 흡착질의 종류와 운전하고자 하는 공정의 특성에 따라 적절한 흡착재를 선택할 수 있는 장점이 있어 널리 사용되고 있는 방법 중 하나이다. 특히, 이러한 흡착재의 경우, 기공크기가 메조기공 범위에서 우수한 제거 효율을 나타내고 있다. 대표적인 흡착재로는 활성탄이 가장 많이 사용되고 있으며, 최근에서는 제올라이트, 활성 알루 미나 그리고 실리카겔 등이 사용되고 있다.
미나 그리고 실리카겔 등이 사용되고 있다.
알루미나는 화학적 침식이 높은 저항성을 갖으며 따라서 산·알칼리, 유기용제 등에 거의 영향을 받지 않는 뛰어난 내약품성을 가지고 있다. 또한 우수한 내열성을 가지고 있어 활성탄에 비해 고온 공정에서도 사용할 수 있는 큰 장점이 있으나 상대적으로 낮은 비표면적으로 인한 흡착 효율이 낮다는 단점을 가지고 있다.
이와 같이 알루미나의 경우에는 이러한 단점을 극복하기 위해 고비표면적인 메조기공 분말을 표면처리함으로써 흡착율을 크게 형상시키고 있다. 이 때, 메조기공의 형상분말은 MCM 계열과 SBA 계열이 주로 활용되고 있다.
한편 흡착재 내부기공에 화학적용기(chemical functional group)를 도입함에 따라 중금속 이온과의 친화성을 높임으로써 흡착 성능을 크게 높일 수 있다[7].
Fig. 5는 작용기를 도입하는 공정을 나타낸 것이다. Fig. 6(a)는 메조포러스 물질에 작용기를 도입하지 않았을 때의 전자현미경 사진이며, Fig. 6(b)는 작용기 도입을 통하여 중금속을 흡착한 경우의 전자현미경 사진이다. 사진에서 보듯이 기공 내외부 표면에 중금속 입자들이 응집흡착된 상태를 보여 지지만 기능기를 도입한 경우에는 기공 내부에 검은 점(중금속)이 더 작은 상태로 균일하게 흡착되어 있음을 확인할 수 있다. 이와 같이 중금속 입자의 기공 내부 담지가 가능함에 따라 이를 거푸집으로 이용한 경우, 나노미터 크기의 입자를 제어 할 수 있다. 특히, 나노 크기로 제어된 금속입자는 De-NOx, DOC 등의 공정에서 나노 촉매로 널리 활용될 것으로 기대된다.
2.3 마이크로 포어(>2nm) 소재
마이크로 기공 크기의 물질의 대표적인 물질로는 제올라이트가 있다. 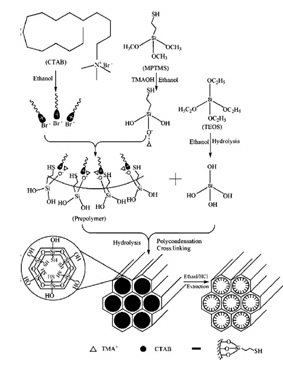 마이크로 기공의 제올라이트와 매크로 기공 크기의 지지체를 이용한 CO2 고온분리막이 있다. Fig. 7는 제올라이트 TEM 사진과 기공크기 분포를 나타낸 것이다. Fig. 2에서 보듯이 마이크로포어가 균일하게 제올라이트 입자내에 존재하는 것을 확인할 수 있었으며 기공크기 분포에서도 대략 0.8nm의 평균 기공크기를 규칙적으로 가지는 것으로 나타낸다. 이러한 나노사이즈의 미세한 기공 특성으로 인하여 CO2 분리 공정 분리막으로 사용되고 있다.
마이크로 기공의 제올라이트와 매크로 기공 크기의 지지체를 이용한 CO2 고온분리막이 있다. Fig. 7는 제올라이트 TEM 사진과 기공크기 분포를 나타낸 것이다. Fig. 2에서 보듯이 마이크로포어가 균일하게 제올라이트 입자내에 존재하는 것을 확인할 수 있었으며 기공크기 분포에서도 대략 0.8nm의 평균 기공크기를 규칙적으로 가지는 것으로 나타낸다. 이러한 나노사이즈의 미세한 기공 특성으로 인하여 CO2 분리 공정 분리막으로 사용되고 있다.
Fig. 8은 현재까지 보고된 각종 제올라이트 막의 CO2 투과 자료이다. 가로는 투과량의 지표가 되는 CO2 투과량이고 세로축은 CO2/N2의 투과계수비이다. 200℃ 보다 낮은 온도에서 Y형 제올라이트가 10 이상의 CO2/N2 투과계수비를 나타낸다. 특히, Y형 제올라이트는 실온에서 100, 130℃에서 15.7로 종래의 무기막에서 찾아볼 수 없는 높은 투과계수비를 나타낸다. 다공성 알루미나 지지체의 표면에 Y형 결정합성을 위한 단결정을 미리 부착시켜 결정화 원료 겔에 12시간 침적하므로써 수열합성법으로 제조한 제올라이트 연구도 진행되고 있다. 이 Y형 제올라이트는 CO2 투과계수비가 100이라는 매우 높은 값을 얻을 수 있었다[8].
제올라이트 중 저실리카 제올라이트는 Si-O-Al의 망상구조 상에 양이온에 기인하는 정전장에 의한 분자가 분극되는 성질을 이용하여 CO2 흡수, 분리하는 공정이 개발되고 있다. 연소배기가스, 화학플랜트 가스로부터 CO2 회수에 대해서는 PSA(Pressure Swing Adsorption)법이 실용화되어지고 있다. CO2 회수를 위하여 제올라이트 막을 이용하는 것 외에도 알루미나를 지지체로 사용하여 표면 개질시키는 연구도 활발히 진행되고 있다. 알루미나의 경우, 내열성은 좋으나 CO2 흡착성이 약하기 때문에 표면에 염기성 산화물을 담지 하여 고온에서 CO2를 흡착시키는 연구가 활발히 진행되고 있다.
또한, 일본의 (주)도시바는 CO2와 반응하기 쉬운 Li 원자와 함께 내부식성과 내화성이 큰 지르코늄 산화물을 혼합시킨 세라믹스를 이용하여 CO2를 흡수시킨 후, 재방출하는 새로운 재료를 개발하였다고 보고하였다. 이 재료는 450~700℃의 고온에서 CO2와 접촉하면 성분 중 리튬산화물이 CO2와 반응하여 액상화합물을 생성하여 표면에 축적된다. 이 재료의 온도를 700℃ 이상으로 높이면 역반응을 일으켜 액상 화합물로부터 CO2를 방출하여 원래의 조성으로 되돌아가며, CO2 축적 용량은 재료 체적의 400배 정도로 매우 크다[9].
3. 맺음말
대기 및 수처리 등의 지구환경보전을 위한 환경오염물질의 정화, 처리에 나노기공 세라믹이 소위 말하는 환경 소재로 폭넓게 응용되고 있다.
이러한 나노 환경 소재의 요체는 다양한 기공구조 제어 기술이 되며 이 기술이 진일보함으로서 기공성 소재의 응용범위는 크게 확대될 것으로 생각된다. 아울러 나노 소재의 환경 분야로의 응용이 확대되기 위해서는 소재 기본물성 변화에 따른 환경오염물 제거특성 변화에 대한 연구 또한 병행되어야 할 것이다. 그러기 위해서는 세라미스트와 환경공학자의 상호보완적인 공동연구를 통한 용합기술의 발전 및 인적교류가 절실히 요구되는 때이다.
참고문헌
[1] IUPAC Manual of Symbols and Terminology, Appendix 2, Part 1, Colloid and Surface Chemistry, Pure Appl. Chem. 31, 578 (1972).
[2] J. K. Park, J. S. Lee and S. I. Lee, Preparation of porous cordierite using gelcasting method and its feasibility as a filter, J. Porous Mater., 203-210 (2002).
[3] H. Y. Kim, S. H. Lee, Y. S. Han and J. K. Park, Preparation of dip-coated TiO2 photocatalyst on ceramic foam pellets, J. Mater. Sci., 6150-6153, (2006).
[4] S. H. Lee, B. I. Oh, and J. G. Kim, Effect of various amendments on heavy minerial oil bioremdiation and soil microbial activity, Bioresource Technology, 2578-2587 (2008)
[5] C. T. Kresge, M. E. Leonowicz, W. J. Roth, J. C. Vartuli, and J. S. Beck, Nature 359, 710 (1992).
[6] S. Wu, F. Li, R. Xu, S. W, and G. Li, Synthesis of thiol-functionalized MCM-41 mesoporous silicas and its application in Cu, Pb, Ag and Cr removal, J. Nanopart. Res., DOI 10.1007/s11051-009-9770-3 (2009).
[7] J. H. Park, J. K. Park, and H. Y. Shin, The preparation of Ag/mesoporous silica by direct silver reduction and Ag/functionalized mesoporous silica by in situ formation of adsorbed silver, Mater. Letters, 156-159 (2007).
[8] K. Ota, K. Kuroda and M. Takahashi, Proc. The 7th Int. Symp. MOLTEN SALTS, PV90-17, 716 (1995).
[9] Y. S. Park, J. H. Kim, J. H. Kim, M. S. Byoun, and K. T. Hwang“, Synthesis of BCY Ceramic Membrane for Hydrogen Separation by Aerosol Deposition Method“, Abstract of The Kor. Hydrogen and New Energy Soc., 231-34 (2009).
Fig 1. 기공성 세라믹의 분류[1]
Fig 2. 입자상 물질 처리용 필터의 미세구조 사진 [출처:한양대 자원환경소재연구실]
Fig 3. 매크로 기공 크기를 가지는 세라믹 지지체 [출처:한양대 자원환경소재연구실]
Fig 4. 메조포러스 물질의 전자현미경 사진 [출처:한양대 자원환경소재연구실]
Fig 5. 메조포러스 물질 내벽의 기능기 도입 모식도[6]
(a) (b)
Fig 6. 중금속 흡착된 메조포러스 물질의 TEM 사진 (a)기능기 없는 상태 (b)기능기 있는 상태 [출처 : 한양대 자원환경소재연구실]
Fig 7. 제올라이트의 TEM사진과 기공크기 분포 [출처:한양대 자원환경소재연구실]
Fig 8. 제올라이트 막의 CO2/N2 분리성능[8]
 박재구
박재구
한양대학교 자원공학과 공학사
일본 東京대학 공학석사
일본 東京대학 공학박사
현재 한양대학교 자원환경공학과 교수
<본사이트는 일부 내용이 생략되었습니다. 자세한 내용은 세라믹코리아를 참조바랍니다.>
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net