골 조직재생용 나노 세라믹 생체재료
윤석영 부산대학교 재료공학부 교수
김태완 부산대학교 재료공학부 박사과정
1. 서론
현대 사회는 고령화 사회로 빠르게 변화하고 있으며, 그 속도는 선진국의 경우에 더 눈에 띄게 나타난다. 고령화 시대를 맞이하여 고령자의 의료비 부담이 사회적인 이슈로 야기되고 있는 실정이며, 내적인 자연 노쇠 현상과 외적인 사고 등에 의한 질병이나 부상으로 인한 인체의 손상된 조직이나 기능을 신속하게 회복시킬 수 있다면 치료비나 입원비를 절감하고 생활의 질도 향상 될 것이다.
손상 받은 조직이나 기능을 회복시키기 위하여 인공적으로 이식이 가능한 생체재료를 생각하게 되었다. 일단 생체재료로 사용되기 위해서는 생체 내에서 독성, 발암성 등 유해 작용이 없어야 하며, 생체조직과 좋은 친화성을 가져야 하고 주변의 조직과 강한 결합을 이루어야 한다. 초창기 생체재료들은 생체 내에서 비활성 특성을 갖는 생체-비활성 (bio-inert) 재료가 대부분이었으며, 이들 재료들은 시술 후 주위 조직의 감염 및 염증 반응 때문에 사용에 많은 제약이 수반되었다. 하지만, 현재는 세포 (간엽줄기세포)와 같은 생체 활성재료를 이용한 조직재생으로 변화되고 있으며, 골유도(osteoinductive), 골전도 (osteoconductive), 골융합(osteointegration)할 수 있는 생체적합성(biocompatible)을 갖는 재료를 설계 및 개발하여 사용부위 및 목적에 따라 다양한 종류의 골 조직 재생용 생체활성 지지체의 개발에 이르렀다. 이러한 골 조직 재생용 생체활성 지지체는 이식되는 부위에 따라 다른 물리적 특성을 가지고 주위조직에 대한 독성반응이 없어야 하는 물성이 요구된다. 이러한 골 조직 재생용 생체활성 지지체는 그 원재료의 특성과 사용목적에 따라 다양한 형태로 시판 및 개발되고 있다.
이에 본고는 일반적으로 독성이 없고 생체와의 친화성이 우수하며, 생체에 이식시켰을 경우 골조직과의 우수한 친화성을 나타내는 골 조직재생용 세라믹 기반의 생체재료 기술의 현황에 대해 소개하고자 한다.
2. 골의 구조 및 특성
골은 세포와 이들 세포간에 존재하는 다량의 골기질(bone matrix)로 이루어져 있다. 골기질은 대부분 교원 섬유(collagen fiber)로 구성된 유기질 성분과 주로 칼슘으로 구성된 무기질 성분으로 이루어진다. 골의 생화학적 구성은 세포 성분을 포함해 유기질 35%, 무기질 45%, 수분 20%로 이루어져 있다. 성숙골은 피질골, 해면골, 골막, 골내막 등의 구조로 이루어진다.
골 조직의 단면을 살펴보면 피질골(cortical bone)과 해면골(cancellous bone)로 나누어진다. 피질골은 뼈의 바깥쪽에 존재하며 기본적인 뼈 단위인 하버시안 계(Haversian system) 또는 골원(osteon)으로 이루어져 있다. 하버시안 계는 골의 장축과 평행으로 배열된 긴 원주형의 구조물로서 그 중앙에 혈관을 내포하는 하버시안 관(Haversian canal)이 있고, 이 관 위로 석회화된 교원 섬유성 층판 즉, 하버시안 층판(Haversian lamellae)이 동심원상 배열을 하고 있다. 하버시안 관 속에는 보통 한 개의 동맥과 두 개의 정맥 및 신경 섬유가 있고, 층판 속에는 소강(lacuna)이라 불리는 작은 공간에 골세포가 존재한다. 하버시안 관에 수직으로 배열된 관들을 통칭하여 볼크만관(Volkmann´scanal)이라하는대 이들은 피질골에서 하버시안관과 골막의 혈관, 하버시안관에서 골수공간, 또한 하버시안관을 서로 연결하는 역할을 하고 있다. 하버시안계는 파골 세포가 터널모양으로 골을 흡수해 나가고 그 뒤를 이어서 골 모세포들이 새로운 골 조직을 생성함으로서 새롭게 형성되는데 이러한 과정은 평생 동안 꾸준히 지속된다.
해면골은 망상골이라고도 하며 골수강 내에 지방 조직이나 조혈 조직 사이에 존재하는 작은 기둥 모양의 골 소주(bony trabecula)로 이루어져 있다. 골 소주 상호 간에는 서로 연결되어 있으며, 골 소주 자체는 층판을 형성하고 있지만 동심성의 피질골과는 달리 층판의 배열이 단순하다. 골 조직은 마이크로 단위에서부터 나노 크기의 성분까지 계층적 구조를 이룬다. 골 조직의 30% 정도는 콜라겐과 다양한 단백질들로 구성된 유기물로, 70% 정도는 수산인회석과 탄산인석 등의 무기물로 채워져 있다. 유기물 중 콜라겐은 골의 탄성과 강인성을 제공해 주며, 콜라겐 외의 200여개의 단백질들은 세포외 환경 속에서 세포와 의 다양한 신호전달 작용을 한다.
3. 골 조직재생용 위한 생체재료
3.1 골 재생용 세라믹 재료
골 결손이 생겼을 때 가장 좋은 치료방법은 자가골(autograft bone)을 이용하는 것으로 특히 장골의 뼈를 일.jpg) 부 채취하여 수술하는 방식이다. 척추융합 수술 과정에서는 자가골을 이용하는 방법을 많이 사용하고 있으며, 자가골은 골전도성과 골유도성을 모두 갖춤과 동시에 골세포까지 포함되어 있어 치료 속도가 빠르며 면역반응이 전혀 없는 장점이 있다. 하지만, 골을 채취하는 부위에 생길 수 있는 병의 부담과 공급에 한계가 있는 단점을 가지고 있다. 자가골의 이러한 단점을 보완하기 위하여 사람시체에서 얻은 동종골(allogeneic bone)이나 소나 돼지 또는 말의 뼈를 가공해서 제조한 이종골(xenogeneic bone)이 이용되고 있지만 이는 면역반응과 합병증의 위험을 가져 이식 전에 여러 병원소 등을 조사하여 제거해야 하는 문제가 있다. 그래서 최근에는 칼슘과 인을 이용한 합성골(synthetic bone)제품이 증가하는 추세이다.
부 채취하여 수술하는 방식이다. 척추융합 수술 과정에서는 자가골을 이용하는 방법을 많이 사용하고 있으며, 자가골은 골전도성과 골유도성을 모두 갖춤과 동시에 골세포까지 포함되어 있어 치료 속도가 빠르며 면역반응이 전혀 없는 장점이 있다. 하지만, 골을 채취하는 부위에 생길 수 있는 병의 부담과 공급에 한계가 있는 단점을 가지고 있다. 자가골의 이러한 단점을 보완하기 위하여 사람시체에서 얻은 동종골(allogeneic bone)이나 소나 돼지 또는 말의 뼈를 가공해서 제조한 이종골(xenogeneic bone)이 이용되고 있지만 이는 면역반응과 합병증의 위험을 가져 이식 전에 여러 병원소 등을 조사하여 제거해야 하는 문제가 있다. 그래서 최근에는 칼슘과 인을 이용한 합성골(synthetic bone)제품이 증가하는 추세이다.
임상적으로 많이 적용되는 세라믹 합성골로 calcium sulphate(CS), hydroxyapatite(HAp), tricalcium phosphate(TCP) 등이 있다. TCP의 경우 HAp보다 훨씬 생분해성이 빨라 비교적 생체내로의 재흡수가 수월하게 이루어지며, CS는 가장 오랜 기간 동안 임상적으로 활용된 골전도물질로 주요결점은 화학반응이 발생할 때 매우 다양한 결정구조가 발생하여 결국 마지막 산물의 성질이 일정치 않다는 것과 주위 골조직이 재생되는 용량을 초과해서 매우 빠르게 흡수된다는 단점을 가지고 있다. 한편, 인체의 뼈 화학성분과 거의 유사한 HAp의 경우 생체 내에서 생분해성이 너무 늦어 임상적으로 적용이 제한적이며, 이를 보완하기 위하여 HAp를 변형 시키려는 시도가 많이 행해지고 있다. 그 중 HAp와 calcium carbonate를 혼합한다든지 혹은 생분해성이 우수한 TCP와 혼합시키는 경우가 있다. [표 1 참조]
3.2 골 재생을 조직공학용 지지체 재료.jpg)
조직공학은 생명과학과 공학의 기본 개념과 기술을 응용하여 생체조직의 구조와 기능 사이의 상관관계를 이해하고, 나아가서 인체조직 및 장기를 대체할 수 있는 인공적 생체조직을 체내ㆍ외에서 재생하여 손상된 우리 몸의 기능을 복원하는 것을 주목적으로 하는 응용학문이다. 골 조직공학은 뼈를 대체할 수 있는 재료를 공급하고 재생시켜 손상된 골 조직을 복원하는데 새로운 뼈를 자라게 하는 세포, matrix, 세포간의 신호전달, 세포-matrix간 상호작용, 성장을 조절하는 성장인자 그리고 뼈와 같은 3차원구조를 형성할 수 있는 지지체(scaffold)가 필요하다.
지지체는 세포의 부착, 분화, 성장 및 세포 이동에 대한 적합한 환경을 제공해야 함으로 그 필수조건으로는 ⅰ) 세포를 부착하고 전달할 수 있을 것, ⅱ) 조직성장을 유도분화하고 촉진시킬 것, iii) 세포 반응을 자극할 것, iv) 생체적합성이며 생분해성을 가질 것, v) 용이한 제조과정과 원하는 형태로 자유자재로 만들 수 있어야 할 것, vi) 큰 표면적과 다공성일 것vii)기계적 강도와 치수 안정성을 가질 것 등이다. 지지체는 다양한 소재를 이용해 제작할 수 있고, 현재, 천연 및 합성 고분자, 생체세라믹스 및 고분자-세라믹 복합소재를 사용하여 조직재생용 지지체를 개발하고자 하는 노력이 진행되고 있다. [그림 2 및 표 2 참조]
제.jpg) 조된 지지체에 골 형성과 발달에 관여하는 것으로 알려진 성장인자인 Bone Morphogenetic Proteins
조된 지지체에 골 형성과 발달에 관여하는 것으로 알려진 성장인자인 Bone Morphogenetic Proteins.jpg) (BMPs), Transforming Growth Factors(TGF-β), Insulin-like Growth Factor(IGF), Platelet Derived Growth Factor(PDGF), 그리고 Fibroblast Growth Factor(FGF)들을 첨가시켜 이식 후 지지체에 골형성을 유도할 뿐만 아니라 골재생을 촉진 시키는 방법을 많이 시도하고 있다. 다공성 HAp를 세포배양 담체로서 응용하여 골수로부터 간엽세포를 채취하여 충분히 배양한 후, HAp 위에서 골아세포로 분화 유도하여 생체로 이식하여 신속한 골 형성을 얻도록 하는 연구가 시도되고 있다. [그림 3 참조]
(BMPs), Transforming Growth Factors(TGF-β), Insulin-like Growth Factor(IGF), Platelet Derived Growth Factor(PDGF), 그리고 Fibroblast Growth Factor(FGF)들을 첨가시켜 이식 후 지지체에 골형성을 유도할 뿐만 아니라 골재생을 촉진 시키는 방법을 많이 시도하고 있다. 다공성 HAp를 세포배양 담체로서 응용하여 골수로부터 간엽세포를 채취하여 충분히 배양한 후, HAp 위에서 골아세포로 분화 유도하여 생체로 이식하여 신속한 골 형성을 얻도록 하는 연구가 시도되고 있다. [그림 3 참조]
지지체를 실제 뼈의 구성 (유기물 30%, 무기물 70%)처럼 유기물의 탄성 및 질긴 정도의 특성에 무기물의 강도를 갖추도록 유/무기 복합재료로 설계 하는 시도가 행하여지고 있다. 세라믹-고분자 복합재료로 Bonfield와 연구자들이 HAPEX라는 복합재료를 개발하였으며 생체내구성을 가지며 생체활성이 있고, 생분해성이 있는 복합재료이다. 해외에서는 90년대 후반과 2000년대에 들어서면서 압축강도를 증가시키기 위한 목적의 monolithic 시멘트에서 벗어나 골 조직 형성 촉진 및 기계적 물성 향상을 위한 방편으로 복합재료화 및 생체활성물질의 전달이 가능한 복합체 및 인공 지지체에 대한 연구가 활성화된 것이 큰 특징이다. 복합 소재에 나.jpg) 노 기술의 도입으로 복합 인공 경조직의 재료의 단점을 개선하려는 것이다. 연구의 핵심 기술은 새로운 합성법에 의한 HAp 나노 결정의 제조공정 개선 및 고분자 매트릭스의 균일한 분산기술이 주를 이루고 있다. 고분자 매트릭스 내 나노 크기의 균일한 분산으로 형성된 나노 복합체는 천연 뼈와 같은 기계적 강도를 보인다는 연구결과가 보고되었다. 또한, HAp 나노입자를 고분자와 단순 혼합하는 것이 아니라, 고분자 지지체 표면에 도입하는 기술을 통해, 골세포의 부착, 분화 및 성장에 이상적인 환경제공을 통해 골재생 기능을 높이려는 시도도 진행 중이다. [그림 4와 5 참조]
노 기술의 도입으로 복합 인공 경조직의 재료의 단점을 개선하려는 것이다. 연구의 핵심 기술은 새로운 합성법에 의한 HAp 나노 결정의 제조공정 개선 및 고분자 매트릭스의 균일한 분산기술이 주를 이루고 있다. 고분자 매트릭스 내 나노 크기의 균일한 분산으로 형성된 나노 복합체는 천연 뼈와 같은 기계적 강도를 보인다는 연구결과가 보고되었다. 또한, HAp 나노입자를 고분자와 단순 혼합하는 것이 아니라, 고분자 지지체 표면에 도입하는 기술을 통해, 골세포의 부착, 분화 및 성장에 이상적인 환경제공을 통해 골재생 기능을 높이려는 시도도 진행 중이다. [그림 4와 5 참조]
최근에는 나노 크기의 유/무기 복합재료들이 마이크로 크기의 재료보다 생물활성이 더 좋다는 연구 결과가 발표되었다. 재료의 표면특성은 삽입물에 세포들이 접착하기 전에 특정 단백질(fibronectin, vitronectin, laminin)의 흡수와 활성을 촉진하고 세포거동을 조절하며 조직재생을 선도한다. 정형외과용 삽입물의 디자인을 위한 중요한 기준은 합성물질과 뼈 조직사이의 충분한 골 결합(osteointegration)의 생성이다. 세포에 알맞은 표면특성을 가진 나노구조 물질이 특정 단백질과의 상호작용이 많이 일어나 새로운 골 성장을 촉진하는 것으로 보고되었다. 나노세라믹, 특히 나노 HA는 골 대체물, 코팅, 충전제로써 우수하다. 나노세라믹의 입도와 결정입계의 높은 표면 거칠기는 부착, 증식, 분화와 같은 조골세포 기능을 증가시킨다. [그림 6 참조]
선도한다. 정형외과용 삽입물의 디자인을 위한 중요한 기준은 합성물질과 뼈 조직사이의 충분한 골 결합(osteointegration)의 생성이다. 세포에 알맞은 표면특성을 가진 나노구조 물질이 특정 단백질과의 상호작용이 많이 일어나 새로운 골 성장을 촉진하는 것으로 보고되었다. 나노세라믹, 특히 나노 HA는 골 대체물, 코팅, 충전제로써 우수하다. 나노세라믹의 입도와 결정입계의 높은 표면 거칠기는 부착, 증식, 분화와 같은 조골세포 기능을 증가시킨다. [그림 6 참조]
미래의 생체 세라믹스는 가능한 분자수준에서 세포와 융합하고 세포의 증식과 분화를 유도하며 뼈의 matrix를 형성할 수 있는 물질로의 기능을 가져야 한다. 이때 폴리머는 물론 나노 단위의 구조를 가진 섬유형 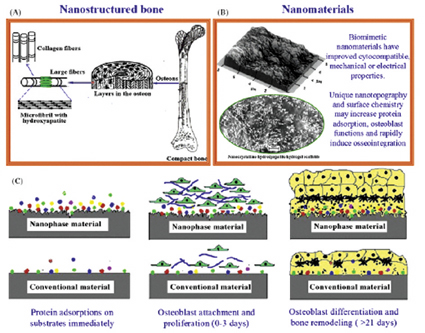 scaffold를 조성해 조직의 콜라겐섬유나 수산화 아파타이트 와 같은 역할이 필요하다. 그리고 scaffold의 표면을 필요한 물질로 처리해 골형성을 유도하고 적절하게 분해를 조절할 수 있는 기계적인 성질을 개선하는 노력도 필요하다. [그림 7 참조]
scaffold를 조성해 조직의 콜라겐섬유나 수산화 아파타이트 와 같은 역할이 필요하다. 그리고 scaffold의 표면을 필요한 물질로 처리해 골형성을 유도하고 적절하게 분해를 조절할 수 있는 기계적인 성질을 개선하는 노력도 필요하다. [그림 7 참조]
5. 맺음말
인간에게 대사조직에 부작용이 없고 생체에 적합한 재료를 만드는 것은 쉽지 않다. 미래 과학 기술의 발전과 함께 인간에게 필요한 생체조직은 분명 중요한 연구 대상 중 하나이다. 생명연장이라는 꿈의 실현은 물론 난치병, 사고 등으로 고통스런 삶을 살아가는 많은 환자들을 위해서 조직공학 및 재생의학의 역할이 중요하고, 이미 고령화 및 산업화 사회에서 건강한 삶을 영위하도록 해 주는 필수적인 학문으로 자리잡고 있다.
인체 친화적이며 생분해성 인산칼슘계 세라믹 다공체를 조직공학용 지지체(scaffold)로 이용하는 연구가 수행되고 있으며, 조직 공학과 연계하여 바이오 인공장기에 대한 연구 개발이 활발히 이루어지고 있다.
생체 세라믹스는 대부분 인체 내에서 사용되기 때문에 세포반응을 통한 in-vitro 시험과 동물 체내에서의 in-vivo 시험 등을 통해 재료 자체의 특성 향상 뿐 아니라 인체 내에서 재료의 세포 및 조직 적합성에 대한 연구가 필수적이어서 학제간 연구가 필요하다. 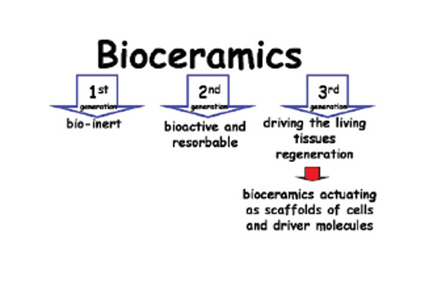
근래에 들어 국내에서는 생체세라믹스 등 생체재료 연구에 있어서 학제간 연구가 유기적으로 이뤄지기 시작하였으며, 생체 세라믹스의 개발에도 좋은 결과물을 기대할 수 있게 되었다. 생체 세라믹스에서는 재료 개발, 재료 가공, 치의학, 임상의학, 정형외과학 등 다양한 분야와 유기적인 협력연구를 통해 새로운 생체 세라믹스의 개발이 가능할 것이다. 향후 인체 내에 매식되어 기능을 다한 후 인체에 흡수 될 수 있는 생분해성 생체 세라믹스의 개발이 필요하고, 나아가 골유도성을 지닌 생분해성 다공체 골대체재료가 요망된다. 또, 조직공학 기술을 사용하여 환자의 조직과 동일한 조직을 재생시키는 것이 요망된다.
재생의료에 의해 골을 재생하는 것은 사람의 신체를 지지하는 것을 재생하는 것이기 때문에 생활의 질적 향상 면에서 아주 중요한 요소다.
현 단계에서 골재생 기술을 이용하는 것은 세라믹스 상에 골아세포나 골기질의 기능을 부가하는 것에 한정이 되어있다. 금후에는 이러한 신체를 지지하는 목적 이외에 조혈환경이나 골대사에 긍정적인 영향을 주는 골재생이 요구되고 있다. 이러한 명제를 달성하기 위하여 더 많은 연구가 진전될 필요가 있다.
참고문헌
1. Stevens, M. M., and George, J. H., Science, Vol.310, p.1135 (2005)
2. Keaveny T, Hayes W, Boca Raton, FL: CRC Press; p.285~344 (1993)
3. Zioupos P, Currey JD, Bone, Vol.22, p.57 (1998)
4. Sedlin E, Acta Orthop Scand (1965)
5. Dong XN, Guo XE, J. Biomech, Vol.37, p.1281 (2004)
6. Giesen E, Ding M, Dalstra M, van Eijden T, J. Biomech, Vol.34, p.799 (2001)
7. Rohl L, Larsen E, Linde F, Odgaard A, Jorgensen J, J. Biomech, Vol.24, p.1143, (1991)
8. Yeni Y, Fyhrie D, J. Biomech, Vol.34, p.1649 (2001)
9. Carter D, Hayes W, J. Bone Joint Surg, Vol.59A, p.954 (1977)
10. Andre´ R. Studart,w Urs T. Gonzenbach, Elena Tervoort, and Ludwig J. Gauckler, J. Am. Ceram. Soc., Vol.89[6], p.1771 (2006)
11. Tomonori Matsuno, Kazuhiko Omata, Yoshiya Hashimoto, Yasuhiko Tabata, Tazuko Satoh, Japanese Dental Science Review, Vol.46, p.188 (2010)
12. Manitha B. Nair, S. Suresh Babu, H.K. Varma, Annie John, Acta Biomaterialia, Vol.4, p.173 (2008)
13. Sung Eun Kim, Hyung Woo Choi, Hong Jae Lee, Jeong Ho Chang, Jinsub Choi, Kyung Ja Kim, Hee Jin Lim, Young Joon Jun and Sang Cheon Lee, J. Mater. Chem., Vol.18, p.4994 (2008)
14. Mathew Peter, Nitya Ganesh, N. Selvamurugan, S.V. Nair, T. Furuike, H. Tamura, R. Jayakumar, Carbohydrate Polymers, Vol.80[3], p.687 (2010)
15. T.J. Webster, in: J.Y. Ying, (Ed.), Advances in Chemical Engineering, Academic Press, New York, p.125-166 (2001)
16. L. Zhang, S. Sirivisoot, G. Balasundaram, T.J. Webster, in: B. Basu, D. Katti, A. Kumar (Eds.), Advanced Biomaterials: Fundamentals, Processing and Applications, John Wiley & Sons, Inc., New Jersey, in press.
17. F.S. Kaplan, W.C. Hayes, T.M. Keaveny, A. Boskey, T.A. Einhorn, J.P. Iannotti, in: S.R. Simon (Ed.), Orthopedic Basic Science, American Academy of Orthopaedic Surgeons, Rosemont, p. 127-185 (1994)
18. R. Vasita, D.S. Katti, Int. J. Nanomed., Vol.1, p.15, (2006)
19. I. Degasne, M.F. Basle, V. Demais, G. Hure, M. Lesourd, B. Grolleau, Calcified Tissue Int., Vol.64, p.499 (1999)
20. T.J. Webster, C. Ergun, R.H. Doremus, R.W. Siegel, R. Bizios, J. Biomed. Mater. Res., Vol.51, p.475 (2000)
21. T.J. Webster, L.S. Schadler, R.W. Siegel, R. Bizios, Tissue Eng., Vol.7, p.291 (2001)
22. T.J. Webster, C. Ergun, R.H. Doremus, R.W. Seigel, R. Bizios, Biomaterials, Vol.22, p.1327 (2001)
23. Mar?a Vallet-Reg? C. R. Chimie, Vol.13, p.174 (2010)
24. Amy J. Wagoner Johnson, Brad A. Herschler, Acta Biomaterialia, (2010)
25. Chikara Ohtsuki, Masanobu Kamitakahara and Toshiki Miyazaki, J. R. Soc. Interface, Vol.6, p.S349 (2009)
26. Sergey V. Dorozhkin, Biomaterials, Vol.31, p.1465 (2010)
27. Maddela Swetha, Kolli Sahithi, Ambigapathi Moorthi, Narasimhan Srinivasan, Kumarasamy Ramasamy, Nagarajan Selvamurugan, International Journal of Biological Macromolecules, Vol.47, p.1 (2010)
28. K. Rezwan, Q.Z. Chen, J.J. Blaker, Aldo Roberto Boccaccini, Biomaterials, Vol.27, p.3413 (2006)
29. Molly M. Stevens, Materials today, Vol.11[5], p.18 (2008)
30. W.J.E.M. Habraken, J.G.C. Wolke, J.A. Jansen, Advanced Drug Delivery Reviews, Vol.59, p.234 (2007)
그림 1. 다양한 길이를 가지는 골 조직의 계층적 구조 : (a) 강한 석회질 외부 치밀층, (b) 골의 장축과 평행으로 배열된 긴 개방성 원주인 Haversian system (또는 골원), (c) 골세포와 콜라겐 섬유와의 상호작용 포 (d) 세포와 기질의 나노구조.[1]
표 1. 임상적으로 주로 적용되는 상용 합성세라믹 제품[2-9]
그림 2. 세라믹 지지체 제조 방법.[10]
표. 2. 골조직공학용 지지체의 성분별 특성
그림 3. 다공성 수산화아파타이트를 이용한 골수 유래 간엽줄기세포 배양.[12]
그림 4. 수산화아파타이트가 표면 고정화된 키토산 스캐폴드 및 골재생 기능.[13]
그림 5. (a)-(c)키토산/제라틴 지지체 (d)-(f)키토산/젤라틴/나노HAP 복합 지지체의
골아세포 부착력.[14]
그림 6. 나노물질의 생체 상호 작용의 이점;(a)골의 자기조립 계층의 나노구조, (b)Ti 나노상과 HA/HRN(helical rosette nanotubes)의 hydrogel 지지체, (c)나노물질과 보통 물질의 생체상호작용 비교.[16-22]
그림 7. 생체 세라믹스의 세대별 변화 추이.[23]
 윤석영
윤석영
부산대학교 재료공학과 학사
Case Western Reserve Univ. 재료공학과 박사
부산대학교 산학협력단 연구산학기획부단장
현재 부산대학교 중소기업 창업보육센터 센터장
현재 한국결정성장학회 이사
현재 한국산업기술연구회 주요사업평가위원회 위원
현재 중소기업진흥공단 중소기업경영선진화 자문위원회 자문위원
현재 부산대학교 재료공학부 교수
 김태완
김태완
부경대학교 응용화학공학부 학사
부산대학교 재료공학과 석사
부산대학교 재료공학과 박사 수료
현재 부산대학교 재료공학과 박사과정
< 본 사이트는 일부 내용이 생략되었습니다. 자세한 내용은 세라믹코리아 2010년 9월호를 참조바랍니다.>
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net