생체세라믹 최신기술개발 동향과 이용전망
윤 석 영_부산대학교 재료공학부 교수
1. 서 론
생체 재료는 ‘의료용의 일부분으로써 생체 조직에 적용하기 적합한 천연 혹은 합성 재료’로 정의한다. 이런 의미에서 생체재료로서 세라믹스는 매우 오래전부터 사용되었다. 4000년 이전의 것으로 추정되는 마야인의 두개골에서 치아대신 조개껍질이 매식되어있음이 발견되었으며, 고대인들도 인체의 손상된 조직이나 장기를 생체재료로서 복구하고자 하는 노력이 있었음을 알 수 있다. 18세기 후반에는 자기(磁器)가 치관(齒冠)으로 사용되었으며, 19세기 후반에는 석고가 정형외과용 및 골충진재로 사용되었다.
20세기 초부터 뼈와 구성성분이 비슷한 삼인산칼슘(tri-calcium phosphate, TCP)이 골대체재 및 골충진재로 제안되었으나 석고나 TCP는 강도가 약해 고하중을 요구하는 부분에는 사용할 수가 없었다. 이들 재료의 대안으로 20세기 중반 알루미나(alumina, Al2O3)가 고관절 재료로 사용되기 시작하였으나 생체 내에서 파괴속도가 빠르다는 많은 보고들이 있었으며, 이는 세라믹스의 가장 큰 약점인 취성 때문이다.
이후 수산화아파타이트(hydroxyapatite, HAp), TCP, 2상 칼슘인산염(biphasic calcium phosphate, BCP)과 같은 인산칼슘계 세라믹스, 생체활성 유리(bioactive glass), 지르코니아(zirconia, ZrO2) 등에 대한 연구가 이루어졌으나 인산칼슘계 세라믹스와 생체활성 유리는 생체활성은 높지만 강도가 약하고, 지르코니아의 경우 비교적 파괴인성과 강도가 높지만 체내에서 침식이 일어나 충격저항성이 낮은 단점을 갖고 있어 적용에 제한이 야기되었다. 하지만, 이들 재료 중 일부는 상용화되어있긴 하지만 뼈를 대체할만한 표면활성이 높으면서 인성과 강도가 좋은 물성을 가진 세라믹스는 아직은 없는 실정이다.
그러나 여전히 세라믹스가 생체재료로서 금속재료나 고분자재료에 비해 많이 연구되고 있는 것은 세라믹스가 생체친화성(bioaffinity) 및 생체적합성(biocompatibility)이 우수하여 체내 이식 시 생체조직과 재료 사이에 섬유상 조직이 생성되지 않고 접착이 가능하다는 장점을 갖고 있기 때문이다.
.jpg)
그림 1.(a) 고대 마야인의 유골에서 나온 임플란트,(b) 현대의 치아 임플란트
이에 본고에서는 생체세라믹스의 인성과 강도를 높이기 위한 기술개발 동향을 검토하고 최근에 많은 각광을 받고 있는 조직공학(tissue engineering), 세포공학(cell en-gineering), 나노-바이오기술(nano-biotechnology), 약물전달 시스템(drug delivery system, DDS) 등의 새로운 기술을 도입하여 다기능을 갖는 생체세라믹스 기술을 소개하고자 한다.
2. 기계적 특성 향상을 위한 기술개발
2.1. 나노구조의 세라믹스 적용
오늘날 공학에서 ‘나노’라는 단어를 제외하기는 어렵다. 재료공학적 측면에서도 나노구조 세라믹스가 마이크로구조의 세라믹스에 비해 기계적 특성이 우수할 것이라는 기대를 갖게 한다. 1990년대부터 진행된 연구결과를 종합하여 보면 나노구조에 의해 기계적 특성이 개선될 수 있다는 보고가 있지만 세라믹의 분산과 소결과정이 매우 어려워 재연성이 떨어지고 작은 나노입자에 의한 강한 반응에 의해 인체에 좋지 않다는 문제점도 있다. 그러나 많은 연구자들은 기계적 특성의 개선을 위해 나노구조에 대한 연구를 진행하고 있다.
마이크로-나노 복합구조, 나노-나노 복합구조가 그 대표적인 예로, 구조의 모식도는 그림 2와 같다. 마이크로크기의 알루미나에 나노크기의 지르코니아를 분산시킨 복합체는 압축강도가 150 MPa 이상이며 산화물계 세라믹스 중 균열성장 속도가 가장 느리다는 연구결과가 있으며, 500㎚이하의 알루미나와 지르코니아가 혼합된 복합체는 인성과 강도의 균형이 매우 우수한 것으로 보고되었다.
.jpg)
그림 2.(a) 마이크로-나노 복합구조의 모식도와(b) 마이크로 알루미나-나노 지르코니아 복합체, (c) 나노-나노 복합구조의 모식도와(d) 나노 알루미나-나노 지르코니아 복합체.1)
인산칼슘계 세라믹스의 경우 1㎛ 미만의 분말을 이용하여 소결체를 제조하고 있지만 소결 후 결정립 크기는 1㎛ 이상이 된다. 자연의 뼈가 나노구조이며, 기계적 특성뿐만 아니라 이온교환성, 단백질 흡수성, 세포응답성 등을 고려할 때 나노 구조는 필수적이다. 최근에는 스파크 플라즈마 소결법을 이용하여 200㎚이하의 결정립 크기를 가지는 소결체 제조에 성공하였고 강도 및 영율(Young’s modulus)이 2배 이상 향상되었다는 보고가 있다.
또한 나노 크기의 재료들이 마이크로 크기의 재료보다 생체활성이 더 좋다는 결과가 발표되었는데, 나노재료의 표면특성은 삽입물에 세포들이 접착하기 전에 특정 단백질(fibronectin, vitronectin, laminin)의 흡수와 활성을 촉진하고 세포거동을 조절하여 새로운 골 성장을 촉진한다는 것이다. 특히 나노 HAp는 골 대체물, 코팅, 충전제로써 그 특성이 매우 우수하며 나노입도와 결정립계의 높은 표면 거칠기는 부착, 증식, 분화와 같은 조골세포 기능을 증가시킨다고 한다. 따라서 나노구조의 세라믹스의 개발을 위해서는 나노분말 합성 및 분산 기술과 함께 스파크 플라즈마, 마이크로웨이브, 고속가열로 등과 같은 빠른 소결기술이 요구되며, 나노구조, 나노입자에 대한 생체안정성 검증 또한 필요할 것이다.
2.2. 비산화물계 세라믹스의 이용
탄화규소(SiC) 질화규소(Si3N4)와 같은 비산화물 세라믹스는 구조적 안정성으로 인해 균열의 성장이 느리며, 세라믹스 중에서 가장 마모 특성이 좋고 인성 및 강도가 높다. 이렇게 우수한 기계적 특성으로 인해 생체재료로서 이용이 가능할 것으로 생각되어 인공고관절에 적용하기 위한 임상 실험이 진행되고 있다.
우수한 기계적 특성을 가지는 비산화물계 세라믹스가 생체재료로서 적용이 늦어진 이유는 생체적합성에 대한 검증이 아직 이루어지지 않았으며, 산화물보다 높은 온도에서 불활성 분위기로 소결해야하기 때문이다.
이러한 이유로 비산화물계 세라믹스보다는 알루미나와 지르코니아와 같은 산화물계 세라믹스가 고하중이 요구되는 생체세라믹스로 각광받아 왔으나 생체적합성 검증과 적절한 소결기술이 개발된다면 비산화물계 세라믹스의 생체재료 이용이 가능할 것으로 기대된다.
표 1. 세라믹 재료의 기계적 특성 1,2) -생략
2.3. 생체모방을 통한 유/무기 복합화
인체의 조직 중에서 경조직(hard tissue)인 뼈(bones)와 치아(teeth)는 다른 조직들과는 달리 교원 섬유(collagen fiber)로 구성된 유기질 성분과 주로 인산칼슘계 화합물로 구성된 무기질 성분으로 이루어지며, 이러한 유기질과 무기질이 일정한 비율로 단순히 섞여 있는 것(mixture)이 아니라 콜라겐의 단백질 섬유에 25~50㎚ 크기의 무기질 결정들이 흡착된 구조로 유기질 내에 규칙적으로 배열되어 있어 유/무기 복합체(composites) 또는 하이브리드(hybrids) 물질이라 할 수 있다.
또한 거시적으로 뼈는, 바깥쪽에는 딱딱한 피질골(corti-cal bone)로 이루어져 있어 뼈에 가해지는 물리적인 힘을 지탱하는 역할을 하며, 내부의 해면골(cancellous bone)은 스펀지와 같이 3차원 다공체 구조이며 골수 세포가 있어 우리 몸의 혈액을 만들어 내는 조혈작용을 한다. 이러한 독특한 구조 때문에 뼈는 가벼우면서도 쉽게 부러지지 않고 튼튼하다. 이와 같은 뼈의 형태학적 측면과 화학적 구성성분을 모방하여 강도와 인성이 뼈와 유사한 재료를 만드는 방법으로 유/무기 복합체가 제안되었는데, 이와 같은 유/무기 복합체는 고분자 또는 세라믹 기지 중 하나를 기반으로 할 수 있다.
고분자 기지의 유/무기 복합체는 세라믹 기지의 유/무기 복합체보다 폭넓게 연구되어 왔으며 최근에는 생분해성 다공성 지지체(scaffold)에 주목하고 있다. 뼈의 성분과 동일한 화학적 구성성분인 콜라겐 기지의 복합체에 관한 연구가 가장 많이 진행되고 있으나, 콜라겐은 동물로부터 추출해야하기 때문에 대량생산에 적합하지 않은 단점을 가지고 있다. 젤라틴(gelatin), 키토산(chitosan), 알긴산(alginate) 등 다른 천연고분자를 이용한 복합체에 대한 연구들도 많이 보고되고 있으나, 우수한 생체적 특성에도 불구하고 체내에서의 생분해속도가 매우 빠르고 이를 제어할 수 있는 기술이 아직 확보되지 않은 상태이며, 여전히 기계적 특성이 좋지 않다.
이와 같은 단점을 보완하기 위하여 생분해속도를 비교적 용이하게 재어할 수 있고 생체친화성이 우수한 polylactic acid(PLA), polyglycolic acid(PGA), poly-(lactic-co-glycolic) acid(PLGA), poly-e-caprolactone(PCL) 등의 생분해성 합성고분자를 이용한 복합체에 대한 연구도 많이 이루어지고 있다.
이들 합성고분자의 생분해속도는 분자량에 따라 차이는 있으나 일반적으로 PGA>PLGA>PLA>PCL 순이며, 이런 특성을 이용하면 생분해속도의 제어가 가능하고 고분자의 우수한 성형성으로 인해 지지체 제조가 용이하나, 기계적 특성이 뼈에 미치지 못하며 크립 저항(creep resistance)이 낮아 아직은 제한적으로 사용되고 있는 실정이다.
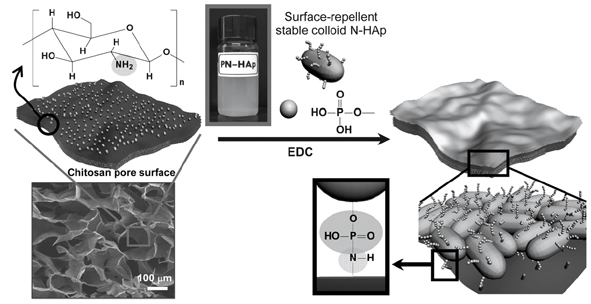
그림 3. HAp가 표면 고정화된 키토산 지지체 및 골재생 기능.3)
세라믹 기지의 유/무기 복합체는 고분자 기지의 유/무기 복합체에 비해 상대적으로 우수한 기계적 특성을 가지고 있으나 많은 연구는 이루지지 않고 있다. 뼈의 구성성분 중 60 wt% 이상이 무기질로 이루어져 있음을 생각하면 기계적 특성이나 생체친화성 측면에서 볼 때 세라믹 기지에 기능성 고분자를 첨가함으로써 조직 재생력을 향상시키고 표면의 기능화를 가능하게 할 수 있는 세라믹 기지 유/무기 복합체 구조가 바람직할 것이다.
이러한 이유로 세라믹스와 고분자의 비율을 뼈와 유사하게 조절한다던지 다양한 고분자물질의 이용하는 등의 시도로 이어지고 있다. 최근 연구결과에 따르면 고분자 기지 내 나노 세라믹입자의 균일한 분산으로 형성된 복합체는 천연 뼈와 같은 기계적 특성을 보인다고 한다. 따라서 새로운 합성법에 의한 나노 세라믹 제조 및 고분자 매트릭스로의 균일한 분산기술, 세라믹 다공체 제조기술, 다공성 기지 표면 제어 기술을 통해, 골세포의 부착, 분화 및 성장에 이상적인 환경제공을 통해 골재생 기능을 높이려는 시도가 필요할 것이다.
3. 생체세라믹스의 기술 융합
현재 생체세라믹스는 조직공학, 세포공학, 나노-바이오기술, 약물전달시스템 등의 새로운 기술을 도입하여 골유도(osteoinductive), 골전도(osteoconductive), 골융합(osteo-integration)을 할 수 있는 이식용 생체재료 및 사용부위 및 목적에 따라 다기능을 갖는 생체 세라믹스에 관한 연구가 이루어지고 있다. 이를 위한 방법으로 줄기세포(stem cell), 메조기공(mesopore), 기능성 나노입자, 약물전달체의 적용에까지 나노 및 바이오 기술과의 전 범위 이종 융합 연구가 활발히 진행 중이다.

그림 4.(a)BCP/PCL 지지체의 표면,(b)나노 HAp를 분산시킨 BCP/PCL 지지체의 표면4)
3.1. 골형성 세포 및 골유도 성장인자의 도입
조직공학은 생명과학과 공학의 기본 개념과 기술을 응용하여 생체조직의 구조와 기능 사이의 상관관계를 이해하고, 나아가서 인체조직 및 장기를 대체할 수 있는 인공적 생체조직을 체내・외에서 재생하여 손상된 우리 몸의 기능을 복원하는 것을 주목적으로 하는 융합학문이다. 골 조직공학적 관점에서 생체내의 기존에 있던 골 결손 부위에 따라 재건하는 형태에 차이가 있다.
예를 들어 골 결손 부위가 작은 곳에는 경우에 따라서 골전도성 재료(osteoconductive materials) 만을 이식해도 주위의 골조직으로부터 골형성 세포(osteogenic cells)와 골유도 성장인자(osteoinductive growth factors)가 들어와서 골형성을 하게 된다. 그러나 골 결손 부위가 클 경우, 단순하게 골전도성 재료만을 삽입하여서는 골의 형성이 불가능하며, 최소한 골형성 세포와 골형성 세포가 살면서 골을 형성 할 수 있는 지지체, 골 성장인자와 충분한 영양공급이 요구된다.
따라서 지지체에 골 형성과 발달에 관여하는 것으로 알려진 성장인자인 골형성단백질(Bone Morphogenetic Pro-teins, BMPs), 형질전환성장인자(Transforming Growth Factors, TGF-β), 인슐린유사성장인자(Insulin-like Growth Factor, IGF), 혈소판유래성장인자(Platelet Derived Growth Factor, PDGF), 섬유아세포성장인자(Fibroblast Growth Factor, FGF) 등을 첨가시켜 이식 후 지지체에 골형성을 유도할 뿐만 아니라 골재생을 촉진 시키는 방법을 많이 시도되고 있으며, 이 중 BMPs은 골형성을 유도할 뿐만 아니라 골재생의 과정을 촉진하는 것으로 알려져 있다.
HAp/콜라겐 복합체에 BMPs를 첨가하여 영장류에 이식한 결과 우수한 골형성을 나타남이 보고되었으며, 골수세포(myelocyte) 또는 간엽줄기세포(mesenchymal stem cells)와 생체활성 세라믹스를 결합하여 사용함으로써 골 결손을 치료했다는 연구 결과도 있다.
또한 다공성 HAp를 세포배양 담체로서 응용하여 골수(bone marrow)로부터 간엽세포를 채취하여 충분히 배양한 후, HAp 위에서 골아세포(osteoblast)로 분화를 유도하여 생체로 이식함으로써 신속한 골형성이 이루어지도록 하는 연구도 시도되고 있다.
이와 같이 다공성 지지체에 골 전구세포(precursor cells)를 성장시켜 이식할 경우 몇 가지 장점이 있는데, 지지체의 표면에 세포 부착이 최대화 되어 전구세포들이 균등하게 덮인 해면구조를 형성시킬 수 있다. 또한 한번 세포가 이식편에 부착을 하게 되면 여러 가지 성장인자의 추가에 따라 체내에 이식되기 이전에도 세포들은 지지체의 표면에서 유골성 기질(osteoid matrix)를 형성하기 시작하여 골조직분화를 촉진시킬 수 있다. 이 같은 특성을 잘 활용한다면 골 결손 부위를 재건할 수 있는 지지체 제조가 가능할 것으로 생각된다.
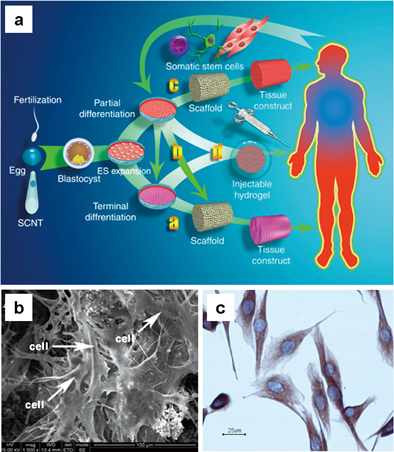
그림 5.(a)조직공학에 있어서 줄기세포의 응용, (b)인간간엽줄기세포가 배양된 콜라겐-HAp 지지체, (c)다공성 HAp를 이용한 골수유래간엽줄기세포 배양.5-7)
3.2. 나노-바이오기술의 응용
나노-바이오 기술이란 분자 규모에서 바이오 물질과 물리, 화학 및 유전학 등을 융합해서 미소한 구조를 합성하는 과학이다. 나노-바이오 기술의 목표는 기능성을 갖는 바이오센서, 마이크로 칩, 피부, 뼈, 근육 등과 같은 생체 조직과 유사한 생물학적 물질을 개발하는 것이다. 나노의학(nano-medicine)이란 나노-바이오기술을 질병의 진단 및 치료에 응용하는 융합기술로, 신체 내 질병부위와 같은 표적을 추적해서 약물이나 진단시약을 전달하는 연구가 가장 중요한 연구대상이 되고 있는데, 세라믹 재료로는 실리카 나노입자, 자성 나노입자 등을 영상획득 및 약물/유전자 전달 분야에 응용하려는 연구가 대단히 활발하게 전개되고 있다.
약물을 입자나 캡슐 내에 삽입한 나노입자나 나노캡슐을 이용해서 표적을 추적하고 전달하면 약물의 투여량을 최소화하고, 부작용을 방지할 수 있을 뿐만 아니라, 인체 내에서 약이 변질되지 않도록 보호해서 약효가 최대한 발휘될 수 있다는 장점이 있는데, 이는 미세다공성 재료(mesoporous materials)의 개발로 가능하다.
미세다공성 재료는 공극크기와 공극표면의 화학적 변환을 통하여 특정 약물분자에 대한 특이성을 조정할 수 있는데, 최근 미세다공성 실리카 입자표면에 ureido-, mercapto-, cyano-, amino-, isocyanato- 등의 관능기를 도입함으로써 실리카 자체의 높은 안정성과 화학적 다양성, 생체적합성, 명확한 구조와 표면특성 뿐만 아니라 기능화 할 수 있는 다양한 표면기능화를 통해 항생물질의 조절방출 뿐 아니라 자성 나노입자, 고분자물질과 미셀(micelle) 등 여러 DDS의 생체적합성 강화에도 실리카의 유용성이 보고되고 있으며, 약물/유전자 전달체로서의 응용이 이루어지고 있다.
마그네타이트(magnetite, Fe3O4), 마그헤마이트(maghe-mite, γ-Fe2O3) 등의 자성나노입자는 바이오기술 분야에 폭 넓게 응용될 수 있다는 가능성 때문에 관심의 대상이 되고 있다. 자성나노입자는 바이러스, 단백질 및 유전자 등과 크기가 유사하고, 외부자장을 이용해서 나노입자의 자화를 조절할 수 있을 뿐만 아니라 입자 표면에 생물학적 기능성 물질을 쉽게 부착할 수 있다는 장점이 있다. 또한 MRI 영상화에 이용할 수 있고, 자기장을 이용해서 인체 내 특정위치에 축적시킬 수 있으며, 자기장을 이용해서 나노입자를 가열해서 결합된 약물은 방출시키거나, 고온으로 가열된 나노입자가 종양을 괴사시킬 수 있다.
또한 나노입자는 종양을 추적할 수 있는데, 종양 혈관은 정상 조직과는 달리 엉성하고 불규칙한 구조로 이루어져 있고, 정상 혈관에 비해서 혈장단백질의 농도가 높다. 따라서 종양 혈관은 투과성이 높고, 기능성 림프관이 부족해서 종양 내에 거대분자들이 축적되기 쉽다. 따라서 나노입자를 혈관을 통해서 주입할 경우 입자들이 수동적으로 고체 종양에 축적될 수 있다.
또한 항체나 리간드를 이용해서 약물을 전달하는 방법은 표적에서만 독특하게 분비되는 항원이나 수용체와 결합하는 분자를 약물에 부착해서 인체에 주입하면 암 세포에 선택적으로 약물을 운반할 수 있다. 이러한 특성을 이용하여 실리카 나노캡슐(hollow mesoporous silica nano-capsule, HMSN), 나노자성입자 등을 이용해서 부작용 없이 암을 치료에 성공하였음이 보고되고 있으며, 종양을 추적할 수 있을 뿐만 아니라 정상세포에 독성을 상대적으로 적게 미칠 수 있다는 점에서 지금의 치료방법을 대체할 수 있을 것으로 보인다.

그림 6. 실리카/마그네타이트 나노입자의 고분해능 투과전자현미경 사진.8)
4. 결 론
생체세라믹스가 주로 경조직인 뼈와 치아에 적용됨을 생각하면 생체세라믹스의 가장 필요한 것은 고인성, 고강도의 기계적 특성이다. 이를 위한 방법으로 나노분말 합성 및 분산 기술, 소결기술 등을 이용한 나노구조의 세라믹스의 개발이 필요하며, 다공체 제조기술, 표면 제어 기술 등을 통해 골세포의 부착, 분화 및 성장에 이상적이며 기공율과 강도를 모두 확보할 수 있는 유/무기 지지체의 제조에 관한 연구가 이루어져야 할 것이다. 또한 학제간 연계를 통해 조직공학, 세포공학, 나노-바이오기술, 약물전달 시스템 등의 새로운 기술을 도입하여 다기능을 갖는 생체세라믹스의 개발도 필요하다.
이러한 재료의 개발 후에도 인체에 적용되기 위해서는 임상실험이 필요하고 정부의 허가를 얻어야 하며 이를 위해 많은 비용과 시간이 요구할 것이다. 그러나 우리나라를 비롯해 전 세계적으로 많은 나라들이 고령화 사회에 접어들었고 이로 인해 삶의 질적 향상을 위하여 생체재료에 대한 수요가 급증 하고 있어 수요에 부합하는 생체재료에 대한 지속적인 연구가 이루어져야한다. 근래에 들어 국내에서도 생체세라믹스 등 생체재료 연구에 있어서 학제간 융합연구가 유기적으로 이뤄지기 시작하였으며, 이러한 노력은 생체세라믹스의 개발에도 좋은 결과물을 기대할 수 있을 것이다.
참고문헌
1. J. Chevalier, L. Gremillaed, J. Eur. Ceram. Soc. 29(2009) 1245.
2. L. L. Hench, J. Am. Ceram. Soc. 81(1998) 1705.
3. S. E. Kim, et al., J. Mater. Chem. 18(2008) 4994.
4. Z.F. Lu, S.-I. Roohani-Esfahani, G. Wang, H. Zreiqat, Nanomed. Nanotech. Bio. Med., In press.
5. C. Chai, K. W. Leong, Molecular Therapy 15(2007) 467–480.
6. J. Zhou, et al., Acta Biomaterialia 7(2011) 3999.
7. M. B. Nair, et al., Acta Biomaterialia 4(2008) 173.
8. M. Arruebo, et al, nanotoday 2(2007) 22-32.
9. J. R. Jones, J. Eur. Cerm. Soc. 29(2009) 1275.
10. W. J. E. M. Habraken, J. G. C. Wolke, J. A. Jansen, Adv. Drug Deliver. Rev. 59(2007) 234.
11. J. P. Ivory, I. H. Thomas, J. Bone and Joint Surg. 75-B(1993) 355.
12. H. Aoki, K. Kato, M. Ogisio, J. Dent. Eng. 18(1977) 86.
13. M. Jarcho, J. Mater. Sci. 11(1976) 2027.
14. D. S. Metzger, T. D. Driskell, J. R. Paulsrud, J. Am. Dent. Assoc. 105(1982) 1035.
15. S. V. Dorozhkin, M. Epple, Angew. Chem. Int. Ed. 41(2002) 3130.
16. I. I. Slowing, J. L. Vivero-Escoto, C.-W. Wu, V. S.-Y. Lin, Adv. Drug Deliver. Rev. 60(2006) 1278~1288.
17. P. Tartaj, et al., J. Mag. Mag. Mater. 290-291(2005) 28-34.
18. S. J. Joris, et al., J. Phys. Chem. 75(1971) 3172.
19. Y. Liu, et al., Int. J. Cancer 120(2007) 2527-2537.
20. M. Vallet-Regi, F. Balas, M. Colilla, M. Manzano, Prog. Solid State Chem. 36(2008) 163-191
21. L. L. Hench, J. M. Polak, Science 295(2002) 1014.
22. S. A. Zijderveld, et al., Int. J. Oral Maxillofac. Implants 20(2005) 432.
23. T. W. Bauer, G. F. Muschler, Clin. Orthop. Relat. Res. 371(2000) 10.
24. L. Levengood et al., Biomaterials 31(2010) 3552-3563.
25. M. Descamps, et al., J. Eur. Ceram. Soc. 28(2008) 149–157.
26. P. V. Moghe, F. Berthiaume, et al., Biomaterials 17(1996) 373.
27. D. A. Tomalia, Prog. Polym. Sci. 30(2005) 294.
28. M. Vallet-Regi, C. R. Chimie 13(2010) 174.
29. J. B. Park, Biomaterials Science and Engineering, p.131, Plenum Press, New York, N.Y., 1990.
30. D. Arcos, I. Izquierdo-Barba, J. Mater. Sci. Mater. Med. 20(2009) 447.
 윤 석 영
윤 석 영
- 1983년 부산대학교 재료공학과 학사
- 1986년 부산대학교 무기재료공학과 석사
- 1998년 Case Western Reserve Univ. 재료공학과 박사
- 2009~2010 현재 한국산업기술연구회 주요사업평가위원회 위원
- 2009~2011 현재 중소기업진흥공단 중소기업경영선진화 자문위원회 자문위원
- 2009~현재 한국결정상장학회 이사
- 2002~현재 부산대학교 재료공학부 교수
< 본 사이트는 일부내용이 생략되었습니다. 자세한 내용은 세라믹코리아 2011년 12월호를 참조바랍니다.>
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net