나노기공구조 제어기술을 이용한 차세대 경조직 재생용 소재개발
윤 희 숙_재료연구소 기능재료연구본부 선임연구원
송 인 혁_재료연구소 기능재료연구본부 책임연구원
1. 서 론
우리나라는 심각한 저 출산율의 진전과 생활환경의 개선 및 의료기술의 발전에 따른 평균수명의 증대로 향후 10년 이내에 국내 총인구의 1/4이 65세 이상이 되는 고령화 사회로 접어들고 있다(그림1 가).1 길어진 수명 동안 인간이 풍요로운 삶을 누리기 위해서는 가령과 함께 저하되는 사회 활동도 및 생산능력 향상을 위한 적극적 노력이 필요하며(그림1 나), 이를 위하여 질병 혹은 가령과 함께 퇴화 혹은 손상되는 신체기능을 재생 혹은 향상시킬 수 있는 기술개발이 강하게 요구되고 있다.
여러 가지 신체기관 중 뼈와 치아로 대표되는 경조직은 인체의 운동 및 음식섭취 기능과 크게 관련되어 있으며, 특히 뼈는 유전성 혹은 영양소 결핍이 원인으로 추정되는 구루병, 파제트병, 골형성 부전증 및 전이암 외 가령에 따라 급격히 발생률이 증가되는 골다공증, 골절, 골관절염 등의 질환으로 인체활동능력을 크게 저하시키게 되는 대표적 기관이다. 현재 전 세계 2억 명 이상이 골다공증을 앓고 있으며, Global Industry Analysts, Inc(GIA)에 의하면 2017년까지 골질환 치료보조제 관련 세계시장은 90억 달러 이상의 규모에 달할 것으로 예상되고 있다.2
뼈는 손상부위가 매우 작은 경우(임계크기 이하) 스스로 재생하려는 능력이 있다. 하지만 손상부위가 임계크기보다 클 경우 스스로 조직을 재생시킬 수 없으며 손상된 조직기능을 회복하기 위해서는 조직재생을 유도할 수 있는 외부인자 즉, 지지체, 세포, 신호물질 등으로 구성된 조직공학 기술을 필요로 한다. 조직공학 기술 중 소재설계·개발과 관련된 요소는 지지체이다. 지지체는 손상된 조직과 조직을 임시적으로 연결시켜 조직의 재생을 유도·촉진하는 다리와 같은 역할을 하며, 조직재생 후 분해되어 없어지는 것이 바람직하다. 따라서 생체적합성과 생분해성이 있는 소재로 구성되는 것이 바람직하며 생체활성과 더불어 세포성장, 혈관생성, 영양분 공급 및 노폐물 배출 등이 원활히 이루어질 수 있는 다공성 구조를 가져야 한다.3
이러한 조건을 만족시키기 위해서는 인체 뼈를 모방한 구조 및 성분으로 구성된 지지체 개발이 요구된다. 인체 뼈는 칼슘·인계 무기질 성분(아파타이트, 건조중량의 약 70%)과 유기질 성분(대표적으로 콜라겐)으로 구성되어 있으며, 나노미터 크기의 아파타이트와 마이크로미터 크기의 콜라겐이 다발을 이루어 계층적으로 구조를 이루어가는 복잡한 구조로 형성되어 있다.4 따라서 뼈재생을 위한 지지체는 조직재생을 효율적으로 유도할 수 있도록 수 나노에서 수백 마이크로미터 크기 영역에서 계층적 기공구조를 구성하여야하며, 각 크기영역의 기공은 그림 2와 같이 상이한 역할을 하게 된다. 하지만 종래의 지지체 개발관련 연구는 대부분 마이크로미터 크기 영역의 기공구조 모방을 중심으로 진행되어 왔다. 최근 나노 크기의 기공 및 결정구조가 세포부착, 증식, 골기질 성분발현 등 조직재생 환경에 미치는 긍정적 효과가 보고됨에 따라 나노크기 영역까지 모방한 지지체 제조법이 주목되고 있다.5 나노기공구조가 제어된 다공성 생체활성유리를 제조하고 이를 이용하여 뼈 재생용 지지체를 제조하는 연구가 그 대표적인 예이다.6
생체활성유리는 SiO2-CaO-P2O5를 주요성분으로 하는 생체세라믹으로 조성, 결정성, 입자크기, 다공도 및 비표면적 등의 화학적·구조적 특성에 따라 소재표면에 생체뼈 유사성분인 아파타이트를 형성시켜 생체조직과 화학적인 결합을 유도하는 생체활성도가 결정된다.7 특히, 솔-젤법으로 제조된 생체활성유리의 경우 비표면적 및 기공체적이 클수록 우수한 생체활성을 나타낸다.8 보다 생체활성이 높은 생체활성유리를 개발하기 위하여 거대 비표면적과 기공체적, 그리고 나노크기 영역에서 규칙적 기공구조를 가지는 메조다공성 물질의 합성법이 응용되었다.
즉, 생체활성유리의 합성에 이용되는 솔-젤법과 병행하여, 고분자의 자기조립화 구조를 주형(template)으로 이용하여 무기질 재료에 전사시킨 후 소성 혹은 용매추출법 등으로 고분자를 제거하여 나노, 특히 메조(2-50nm) 크기 영역에서 규칙적 기공구조를 무기질 재료에 형성시키는 고분자 주형법 적용이 제안되었다. Zhao 그룹은 메조다공성 생체활성유리(Mesoporous Bioactive Glass, MBG)의 합성 가능성과 뛰어난 생체활성을 2004년에 최초로 보고하였으며, 이를 기점으로 새로운 생체활성유리의 합성법으로 주목되어 많은 관련 연구들이 활발히 진행되고 있다.6
본고에서는 비교적 새로운 연구분야인 메조다공성 생체활성유리와 관련된 최근 연구동향을 정리하여 기초합성 기술과 더불어 지지체 소재로써의 활용법까지 제안되고 있는 연구를 소개하고자 한다.
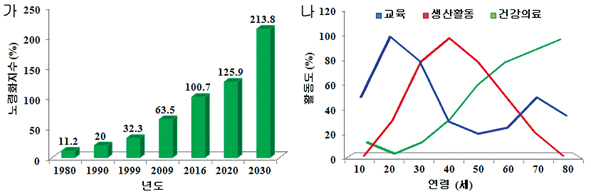
그림 1. 한국사회의 고령화 추세(가)(보건복지통계연보 2010) 및 생애활동도 변동표
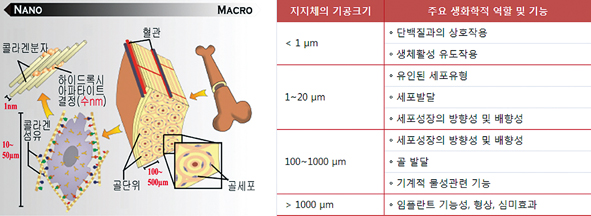
그림 2. 생체 뼈조직 구성(좌)과 지지체 기공크기에 따른 생화학적 기능(우)
2. 본 론
2.1. 메조다공성 생체활성유리 합성 및 생체활성 평가
생체활성유리의 일반적 생체활성은 체내 이식 후 재료 내 Ca2+, PO42-, Si4+ 등의 이온이 체액으로 용출됨과 동시에 재료의 표면에 실리카겔 층이 형성되며, 이 불안정한 에너지를 가지는 실리카겔 층으로 칼슘과 인이 재석출하여 아파타이트 결정을 생성시킴으로 유도된다고 이해되고 있다.7 따라서 생체체액과 접촉 가능한 비표면적이 클수록 높은 생체활성을 기대할 수 있다.8 블록공중합체 및 계면활성제를 주형으로 활용하여 메조다공성 구조를 유도하는 합성법은 종래의 솔-젤법으로 합성되어지는 생체활성유리에 비해 월등히 우수한 기공구조를 형성시킬 수 있으며, 이에 따라서 높은 생체활성 발현이 기대된다.
그림 3은 일반적 생체활성유리(가)와 메조다공성 생체활성유리(나, 다)의 투과전자현미경 관찰결과이다.9 그림에서 볼 수 있듯이 일반적 생체활성유리의 경우 특정한 기공구조의 형성이 관찰되지 않지만 메조다공성 생체활성유리의 경우 약 4nm 크기의 메조기공이 규칙적으로 나열되어있는 것을 확인할 수 있다. 또한, 주형으로 이용한 삼블록 공중합체의 구조(poly(ethylene oxide)m-poly(propylene oxide)n-poly(ethylene oxide)m, EOmPOnEOm)에 따라 m=20, n=70으로 구성된 Pluronic P123의 경우 2차원 Hexagonal 구조(나)로, m=132, n=50인 Pluronic F108의 경우 3차원 Cubic 구조(다)로 메조기공구조의 제어가 가능하다. 메조기공구조는 CaO의 함량비에 따라서도 제어 가능하다고 보고되어지고 있다.10
그림 4에 본 연구그룹에서 합성된 메조다공성 생체활성유리의 질소흡탈착 평가결과를 일반적 솔-젤법으로 합성된 생체활성유리와 비교하여 정리하였다. 생체활성유리에 메조기공구조를 형성시키는 것으로 일반적 생체유리에 비해 2배 이상 큰 비표면적을 얻을 수 있다. 또한 주형으로 계면활성제인 CTAB(cetyltrimethyl-ammonium bromide)을 사용하면 비표면적과 기공체적 특성을 약 5배 이상 향상시킬 수 있다.11
이러한 재료 내 메조기공구조의 형성은 비표면적과 기공체적 특성의 비약적인 향상과 더불어 효율적인 이온확산 경로의 확보를 통하여 생체활성 특성의 큰 개선을 기대할 수 있다. 생체활성을 평가하기 위해 생체유사체액(SBF)에 각각의 재료를 침적시킨 후 표면변화를 관찰하면, 일반적 생체활성유리의 경우 아파타이트 생성에 약 3일 정도가 소요되는데 반하여, 메조다공성 생체활성유리의 경우 약 4시간 경과 후 아파타이트 결정상의 생성이 확인되었다.12
즉, 큰 비표면적은 높은 반응성을 유도하여 빠른 이온교환과 더불어 소재 표면에 높은 밀도의 실라놀 그룹층의 생성을 유도하며, 이는 빠른 비정질 아파타이트층의 형성과 동반된 보다 빠른 결정질 아파타이트층의 생성, 즉 높은 생체활성을 유도하게 된다.13 이러한 높은 생체활성은 메조다공성 생체활성유리의 경조직 재생용 소재로써의 응용가능성을 시사한다.

그림 3. 일반적 생체활성유리(가)와 메조다공성 생체활성유리(나-다)의 메조기공구조 특성 비교
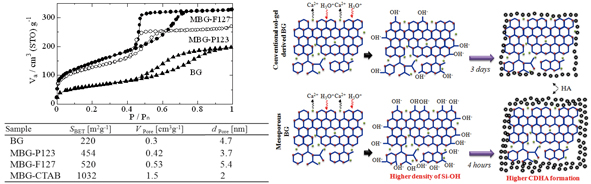
그림 4. 생체활성유리의 기공구조 특성비교 및 생체활성발현 메커니즘
2.2. 약물전달 기능부여
메조다공성 물질의 바이오소재분야 응용이 주목되기 시작한 것은 나노크기영역에서 균일하게 입자의 크기 및 형상 제어가 가능한 기술이 제안된 2000년 초반부터이다.14 입자의 형상과 크기는 물질의 체내 이동과 침투 및 확산거동, 독성발현 등과 깊은 관계가 있기 때문이다. 이 시점부터 주목되기 시작한 응용분야는 화학물질을 담체재료와 결합시켜 외부환경으로의 확산과 방출을 제어하는 약물전달시스템용 담체이다. 메조다공성 물질의 큰 유효 비표면적은 많은 양의 약물을 담지할 수 있고, 제어 가능한 기공크기는 약물 등의 선택적 흡착과 더불어 방출속도의 제어가 가능하며, 대표적인 메조다공성 물질인 메조다공성 실리카의 경우 표면에 높은 농도의 실라놀 그룹을 보유하고 있어 표면수식이 용이하여 약물의 기능기와 상호작용을 유도할 수 있으므로 높은 선택성과 기능성을 가지기 때문이다.
이러한 메조다공성 물질의 약물전달체로써의 가능성은 실리카를 기본 조성으로 칼슘과 인 성분을 포함하고 있는 메조다공성 생체활성유리에도 적용이 가능하다. 즉, 높은 생체활성이 확인되어 조직공학용 소재로써의 활용가능성이 기대되는 메조다공성 생체활성유리에 약물전달기능을 부여함으로써 소재의 기능성을 향상시켜, 골조직재생 유도와 선택적 치료 기능을 동시에 수행할 수 있는 다기능성 신소재 개발을 기대할 수 있다.11 아직 개발 초기단계에 있는 연구이며 여러 가지 약물, 단백질, 펩타이드 및 성장인자 등을 메조기공에 담지하여 그 방출 효과와 효율을 조사하는 연구들이 진행되고 있다.
대표적인 예로, 항생·항염·진통제인 ibuprofen,15 genta-micin,16 dexamethasone,17 tetracycline18 등과 골다공성 치료제인 sodium alendronate19 등을 메조다공성 생체활성유리에 담지한 후 그 흡착 및 방출거동과 그 유효성을 조사하는 연구와 Parathyroid hormone-related protein(PTHrP)20과 BMP-221등의 단백질을 이용하여 골재생과 성장, 분화를 촉진시켜 조직재생의 상승효과를 조사하는 연구, 그리고 선택적 골암 치료효과 등을 고려하여 온열 치료가 가능한 Fe3O4 나노입자를 메조다공성 생체활성유리에 첨가하기위한 복합체의 합성법 개발22 등이 시도되고 있다.
2.3. 소량원소 첨가에 의한 기능성 향상
메조다공성 생체활성유리는 매우 높은 in-vitro 생체활성을 가지나 특유의 생리활성을 가지는 소량의 무기질 성분을 생체활성유리 프레임 내에 첨가하는 것으로 보다 그 기능성을 증진시키려는 노력이 시도되고 있다. 대표적으로 Ce3+는 신경보호제로 활용되며 골아세포의 증식, 분화, 그리고 석회화에 긍정적인 효과가 보고되고 있다.23 한편 Ga3+와 Zn2+는 항균성 제제로 사용되며 골대사의 생리조절활성기능과 관련하고 있다.
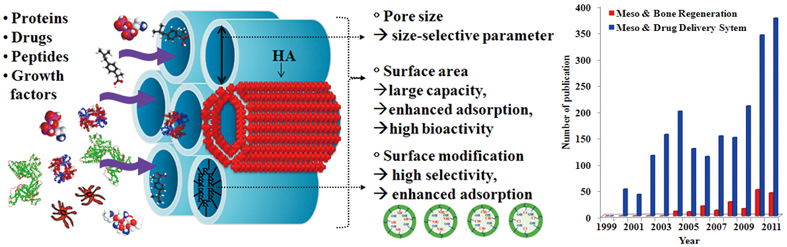
그림 5. 메조다공성 물질의 바이오 소재로써의 가능성(좌)와 연구동향(우)
그림 6. 소량의 무기질 첨가물에 따른 메조다공성 생체활성유리의 기능성 향상
특히 Ga3+는 골격의 기계생물학적 물성을 증진시키고, Zn2+는 골형성에 긍정적 영향을 미치는 것으로 알려져 있다.23 또한, Sr2+는 골 형성 촉진과 골흡수 감소 효과로 골아세포의 활성을 증진시키는 효과가 있으며,24 그 외 B2+와 Mg2+ 또한 각각 골성장과 골대사에 긍정적 효과가 보고되고 있다.21, 25
이러한 무기질 성분은 첨가량이 많은 경우 부정적인 효과도 보고되고 있어 그 첨가량의 조절이 필요하다. 메조다공성 생체활성유리의 프레임에 이상의 무기질 성분을 첨가하여 기능성을 향상시키려는 연구는 대부분 2011년에 연구결과가 보고되기 시작하고 있는 개발초기단계의 이슈이다.
아직은 메조구조 특성을 저하시키지 않고 각 무기질 성분을 첨가하는 합성법에 관한 연구와 합성된 소재가 세포에 미치는 기초적 영향을 조사하는 단계이며, 그 긍정적인 효과가 보고되고 있고 향후 면밀한 논의를 통해 새로운 개념의 생체활성세라믹소재 개발이 기대되는 분야이다.
2.4. 메조다공성 생체활성유리의 형상제어(구형입자)
일반적인 메조다공성 생체활성유리는 벌크형상으로 얻어지며 분쇄하여 분말화 한 후 목적에 맞추어 활용되고 있다. 생체소재의 형상과 크기제어는 임상적 응용에 있어서 체내 이동성, 생체적합성 및 취급용이성 등에 있어 매우 중요하다. 특히, 구형의 나노입자의 경우 세포내 침투효율, 면역반응 및 재료 확산 등에 큰 영향을 미친다.
고분자 주형법과 arerosol-assisted route를 단계별로 적용하여 0.1-3 마이크로미터 크기의 메조다공성 생체활성유리의 합성 예가 보고되었으며 고분자 주형으로 계면활성제를 이용하고 CaO의 함량을 조절함으로써 수십-수백 나노크기의 메조다공성 생체활성 구형입자 및 입자크기제어가 가능함이 보고되었다.11, 26
또한, 삼블럭공중합체를 주형으로 이용하되 소수성 용매를 이용하여 고분자의 자기재조립현상을 유도하는 것으로 수백 마이크로미터 크기의 다공성 생체활성유리 구형입자의 합성이 가능하며, 소수성 용매 내 반응시간의 제어로 입자내 기공구조를 수 나노미터에서 수백마이크로 미터 크기 영역에서 계층적 기공구조 제어가 가능함이 보고되었다.27 각각의 물질을 이용하여 기공구조 변화에 따른 생체적합성, 면역반응성 및 골재생 유도능 평가도 실시되었으며 기공구조가 이들의 특성에 큰 영향을 미치는 것이 보고되었다.28-29
즉, 같은 조성, 같은 전구체 용액에서 출발하여 같은 형상과 크기로 합성된 다공성생체활성유리 구형입자를 메조기공구조만 가지는 것과 계층적 기공구조체를 가지는 것으로 구분하여 체외, 체내에서 생체적합성 등을 평가하였다.29 그 결과 메조기공구조만 가지는 재료의 경우 토끼의 두개골에 이식 8주 후 희생시켜 각 면역장기와 혈액검사 및 골형성정도를 평가하였을 때 조직이상이나 염증발현인자 등의 검출 없이 원만히 신생골이 자라고 있는 반면에, 계층적 기공구조를 가지는 재료의 경우 심각한 장기독성과 면역독성 반응이 확인되었으며 골재생 능력도 현저히 떨어지는 것이 확인되었다. 이러한 차이는 기공구조에 따른 생분해성과 크게 관련되어 있을 것으로 예측, 확인되었으며 따라서, 기공구조의 제어는 생체세라믹소재 개발에 있어서 검토해야할 중요한 요인임이 확인되었다.
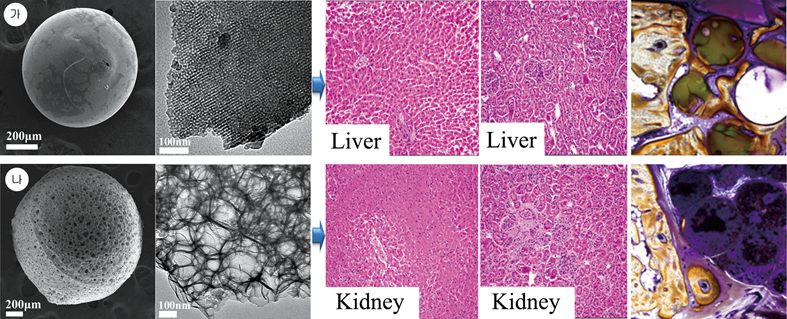
그림 7. 메조다공성 생체활성유리(가)와 계층적 다공성 생체활성유리(나)의 체내이식 8주 후 거동비교
2.5. 3차원 다공성 지지체 제조
메조다공성 생체활성유리를 이용한 3차원 지지체 제조는 본 연구그룹에 의하여 처음 제안되었다.30-31 본 연구그룹에서는 컴퓨터 프로그램으로 지지체의 크기 및 형상 등을 제어할 수 있고 3차원으로 연결된 기공구조의 제어가 가능하여 환자 맞춤형 지지체 제작이 기대되어 최근 주목받고 있는 쾌속조형법(rapid prototyping method)을 메조다공성 생체활성유리 합성법과 함께 활용하여 세라믹 혹은 세라믹-고분자 복합 지지체 제조에 성공하였다.
제조된 지지체는 수 나노미터에서 수십 마이크로미터, 수백 마이크로미터까지 생체골 구조가 가지는 기공크기를 모방하여 재현할 수 있었으며 제조된 지지체는 메조다공성 생체활성유리의 높은 생체활성에 의해 우수한 생체활성을 나타냄이 확인되었다.30 생체활성유리만으로 제작된 세라믹지지체의 경우 지지체에 필요한 조건들을 대부분 만족시키나 취성 때문에 기계적 강도조건을 만족시키지 못하였다. 이를 보완하기 위하여 생분해성 고분자와 메조다공성 생체활성유리의 복합지지체 제조가 제안되었으며 그 결과, 세라믹 지지체에 비해 기계적 강도특성이 10배 이상 향상된 지지체 제조가 가능함이 확인되었다.31
본 연구를 기점으로 많은 연구그룹에서 메조다공성 생체활성유리를 이용한 3차원 지지체 제조를 시도하고 있으며 폴리우레탄 스폰지 주형법, 염침출법이 주로 활용되고 있으나 이들의 경우 뼈재생용 지지체로써의 구조적 및 기계적 조건을 충분히 만족시키지 못하고 있다.16,32 최근에는 메조다공성 생체활성유리를 포함한 3차원지지체를 제조하고 위의 2-2와 2-3에서 소개한 방법과 복합하여 높은 기능성과 생체활성을 가진 신개념의 지지체 제조법 개발에 많은 연구가 진행되고 있다.21, 25
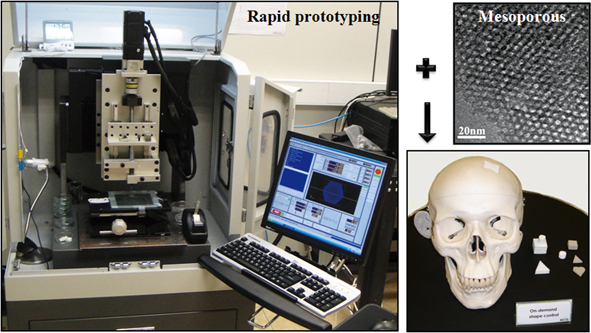
그림 8. 메조다공성 생체활성유리를 포함한 3차원 지지체 제작
2.6. 메조다공성 생체활성유리의 생체활성을 이용한 지지체 코팅
메조다공성 생체활성유리는 주성분으로 인과 칼슘을 함유한 재료로 조성에 따라 뼈융합과 생분해를 통하여 뼈재생을 유도한다. 이들이 방출하는 이온들은 세포가 세포외 기질을 형성하도록 한다. 생체 뼈기질의 무기질 주요 성분은 아파타이트이며 유기질 주요 성분은 콜라겐이다. 아파타이트는 높은 세포친화성과 단백질 흡착성을 가지며 우수한 골전도성을 유도한다.
또한, 콜라겐은 골아세포와의 상호작용이 좋아 초기 세포부착환경을 양호하게 해주는 효과가 있다. 한편 메조다공성 생체활성유리는 매우 높은 생체활성을 띄므로 SBF 내에서의 단시간 침적으로 균일하게 아파타이트층의 형성을 유도할 수 있다. 이를 이용하여 본 그룹에서는 메조다공성 생체활성유리를 포함한 지지체를 제조, 콜라겐을 균일하게 분산시킨 SBF 용액 내에 24시간 이내로 침적시키는 것으로 아파타이트와 콜라겐을 동시에 지지체 표면에 코팅하는 방법을 제안하였다.33 이렇게 메조다공성 생체활성유리를 생체에 바로 이식하지 않고 골기질 유사성분을 코팅하는 공정은 메조다공성 생체활성유리의 높은 생체활성으로 인한 국부적으로 급격한 pH변화가 일어나 세포독성을 나타내는 단점을 보완하는 효과도 있다.
위의 단순한 공정은 PCL(poly ξ-caprolatone)-MBG 복합지지체 표면에 신속하고 균일하게 골기질성분, 아파타이트-콜라겐을 코팅하는 효과가 있었으며, in-vitro 실험에서 세포 부착, 증식, 분화거동 모두를 증진시키는 효과가 있음을 확인하였다. 또한 아파타이트, 콜라겐 각각을 지지체에 코팅하는 것 보다 두 성분을 동시에 코팅하는 것이 골아세포거동에 있어 시너지효과를 나타내는 것이 확인되었다. 이렇게 제조된 지지체는 서론에서 소개한 경조직재생용 지지체에 요구되는 조건 즉, 생체적합성, 생분해성, 생체활성, 3차원 기공구조 및 우수한 기계적 특성 모두를 만족시키고 있어 메조다공성 생체활성유리에 약물전달기능 등 기능성을 추가로 부여할 수 있다면 신개념의 차세대 지지체 소재로써의 응용이 기대된다.
3. 결 론
나노 크기영역에서 기공구조가 제어된 메조다공성 재료의 우수한 구조적 특성을 경조직 재생분야에서 활용하기 위한 노력이 최근 시작되었다. 그 대표적인 소재로 메조다공성 재료의 구조특성을 잘 살리면서 높은 생체활성과 골유도성을 가지는 메조다공성 생체활성유리가 제안되었다. 본고에서는 현재까지 진행되고 있는 관련 연구동향을 소개하였다.
현재까지의 연구는 대부분 메조다공성 생체활성유리의 합성법 개발과 그 기초 특성평가와 같은 기초분야 연구이며 경조직 재생용 소재로써의 높은 가능성이 제안되고 있다. 하지만 메조다공성 생체활성유리를 경조직 재생용 소재로써 활용하여 소재로써의 유의성을 높이기 위해서는 지지체 혹은 충진재 등으로 활용 가능한 부가적인 기술과의 접목이 요구되며 본 그룹을 중심으로 관련 연구가 시작되고 있다. 메조다공성 생체활성유리를 비롯한 메조다공성 생체세라믹 소재는 메조기공구조 자체가 뼈형성을 유도하는 역할을 하거나, 항생제, 항염제, 뼈형성 유도물질 등 약물 및 단백질을 담지하여 치료 및 뼈형성을 돕는 담체 역할을 하는 등, 경조직 재생에 있어 단독 혹은 복합적인 기능발현이 기대된다. 또한 메조다공성 재료를 이용한 controlled release와 관련된 기존 기술과의 접목으로 주변환경에 따라 약물을 방출하는 자가치유능력을 가진 신개념의 경조직 지지체의 실현도 기대된다.
이를 위하여서는 재료학 전문가만의 노력으로는 성공할 수 없으며 재료공학-화학-생물학-면역학-약학-의공학-의학 등 다분야간의 협동연구가 반드시 필요하다. 이러한 이분야간의 경계를 낮춘 협동연구로 새로운 개념의 생체재료 개발이 기대되며 이러한 노력으로 현실화된 고령화 사회의 밝은 미래가 약속될 것이다.

그림 9. 메조다공성 생체활성유리의 생체활성을 이용한 골기질 성분 코팅
감사의 글
본 연구는 2011년 정부(교육과학기술부)의 재원으로 한국연구재단의 지원을 받아 수행 중으로, 이에 감사드립니다.(2011-0017572).
참고문헌
1. 보건복지부, 2010 보건복지통계연보, 56호(2010)
2. http://www.strategyr.com/
3. D. W. Hutmacher, Biomaterials, 21, 2529(2000)
4. M. M. Stevens, Science, 310, 1135(2005)
5. L. Zhang, T. J. Webster, Nano Today, 4, 66(2009)
6. X. Yan, C. Yu, X. Zhou, J. Tang, D. Zhao, Angew. Chem. Int. Ed. 43, 5980(2004)
7. L. L. Hench, J. Am. Ceram. Soc., 81, 1705(1998)
8. M. Vallet-Regí, C. V. Ragel, A. J. Salinas, Eur. J. Inor. Chem., 1029(2003)
9. H. S.Yun, S. E. Kim, Y. T. Hyun, Solid State Sci. 10. 1083(2008)
10. I. Izquierdo-Barba, D. Arcos, Y. Sakamoto, O. Terasaki, A. López-Noriega, M. Vallet-Regí, Chem.Mater.20, 3191(2008)
11. H. S. Yun, S. H. Kim, S. Y. Lee, I. H. Song, Mater. Letter, 64, 1850(2010)
12. H. S. Yun, S. E. Kim, Y. T. Hyun, Mater. Letter, 61, 4569(2007)
13. I. Izquierdo-Barba, Vallet-Regí, Solid State Sci. 13, 773(2011)
14. B. G. Trewyn, G. Supratim, I. I. Slowing, V. S. Y. Lin, Chem. Commun, 3236(2007)
15. Y. Fan, P. Yang, S. Huang, J. Jiang, H. Lian, J. Lin, J. Phys. Chem. C, 113, 7826(2009)
16. Y. Zhu, S. Kaskel, Micropor. Mesopor. Mater. 118, 176(1187)
17. C. Wu, Y. Pamaswamy, Y. Zhu, R. Zheng, R. Appleyard, A. Howard, H. Zreiqat, Biomaterials, 30, 2199(2009)
18. F. Balas, M. Manzano, M. Colilla, M. Vallet-Regí, Acta Biomater. 4, 514(2008)
19. F. Balas, M. Manzano, P. Horcajada, M. Vallet-Regí, J. Am. Chem. Soc. 128, 8116(2006)
20. D. Lozano, M. Manzano, J. C. Doadrio, A. J. Salinas, M. Vallet-Regí, E. Gomez-Barrena, P. Esbrit, Acta Biomater. 6, 797(2010)
21. C. Dai, H. Gua, J. Lu, J. Shi,. J. Wei, C. Liu, Biomaterials, 32, 8506(2011)
22. X. Li, X. Wang, Z. Hua, J. Shi, Acta Biomater. 56, 3260(2008)
23. A. J. Salinas, S. Shruti, G. Malavasi, L. Menabue, M. Vallet-Regí, 7, 3452(2011)
24. C. Wu, W. Fan, M. Gelinsky, Y. Xial, P. Simon, R.Schulze, T. Doert, Y. Luo, G. Cuniberti, Acta Biomater. 7,1797(2011)
25. C. Wu, R. Miron, A. Sculean, S. Kaskel, T. Doert, R.Schulze, Y, Zhang, Biomaterials, 32, 7068(2011)
26. D. Arcos, A. Lopez-Noriega, E. Ruiz-Hernandez, O.Terasaki, M. Vallet-Regí, Chem. Mater. 21, 1000(1009)
27. H. S. Yun, S. E. Kim, Y. T. Hyun, Mater.Chem.Phys., 115,670(2009)
28. S. Y. Lee, H. S. Yun, S. H. Kim, Biomaterials, 32, 9434(2011)
29. H. S. Yun, J. W. Park, S. H. Kim, Y. J. Kim. J. H. Jang,
Acta Biomater. 7, 2651(2011)
30. H. S. Yun, S. E. Kim, Y. T. Hyun,Chem. Commun. 2139(2007)
31. H. S. Yun, S. E. Kim, Y. T. Hyun, S. J. H대, J. W. Shin, Chem. Mater. 19, 6363(2007)
32. J. Wei, F. Chen, J. W. Shin, H. Hong, C. Dai, J. Dai, C. Liu, Biomaterials, 30, 1080(2009)
33. H. S. Yun, S. H. Kim, D. Khang, J. Choi, H. H. Kim, M. Kang, Inter. J. Nanomedi. 6, 2521(2011)
 윤 희 숙
윤 희 숙
- 2004년 University of Tokyo 재료학전공 박사
- 2004년 National Institute of Advanced Industrial Science and Technology(AIST), Japan 박사후 연구원.
- 2005년 Waseda University 강사
- 2006년~현재 재료연구소 엔지니어링세라믹연구그룹 선임연구원
.jpg) 송 인 혁
송 인 혁
- 2003년 KAIST 재료공학과 박사
- 2005~2006년 창원대학교 세라믹공학과 겸임교수
- 1992년~현재 재료연구소 엔지니어링세라믹연구그룹 그룹장/책임연구원
<본 사이트는 일부 내용이 생략되었습니다. 자세한 내용은 세라믹코리아 2011년 12월호를 참조바랍니다.>
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net