Hydroxyapatite 나노유·무기복합체를 이용한 생체 재료연구
장 명 철_군산대학교 신소재공학전공 교수
1. 인공뼈와 생체모방과학
뼈(bone)는 인체를 구성하는 골격구조(Scaffold) 물질로서, 일차적으로 적절한 기계적 강도 및 인성을 갖는 버팀목으로서의 역할을 한다. 이는 일반건축물에서의 철강과 콘크리트로 이루어지는 골격구조체에서의 버팀목역할은 유사하나 근본적으로 이와는 다른 유무기생체물질로서 세포가 갖는 신진대사기능을 가장 기본으로 하여 생명유지에 중요한 역할을 하게 된다. 이러한 기능을 갖는 뼈는 그림 1에서와 같이 인산칼슘결정체(Calcium phosphate minerals)와 단백질 사이의 나노복합체(Nano-composite)로 이루어져 있다. 인체의 활동, 건강유지, 뼈의 보수를 위해 임상에서 요구하는 인체뼈의 기계적 특성, 화학적 특성, 바이오특성 등을 두루 다루는 뼈과학(bone science)이 의과학을 중심으로 발전되어왔다1,2). 1980년대에 이르러 생체조직인 뼈를 실험실적으로 만들어보려는 시도가 있어왔고 이러한 시도는 생체모방과학(Bio-mimetic Science)이라는 새로운 학문분야를 활용하여 발전되어왔다 3-5).
인체에서 뼈는 인산칼슘화합물인 수산화아파타이트(Hydroxyapatite, HA)와 콜라겐(Collagen, COL) 사이에서의 생리적, 화학적 결합으로 이루어진 나노복합체로 알려져 있다. 이러한 인체에서의 뼈생성과학을 바탕으로 하여 실제뼈의 나노구조와 유사한 HA/COL 복합체가 만들어져 왔다1,2,4). I형 콜라겐을 이용한 인공뼈 제조에 있어 원료 및 이후의 가공공정이 간단치 않고 출발물질로서 I 형 콜라겐의 수급 및 가격이 쉽지 않은 문제가 되어왔다. 콜라겐에 있어 또 다른 문제는 일반적으로 많이 사용하는 I형 콜라겐 이외에 뼈의 물리화학적, 생리적 요구를 맞추기 위해서는 다른 형태의 콜라겐(II, III, IV 형) 등을 첨가하여야 하는데 가격이 기하급수적으로 올라가고 수급이 쉽지 않다. 이밖에 콜라겐은 생체물질로서 환자의 면역학적 적합성이 요구된다. 더욱 어려운 점은 인체 내에서의 뼈는 부위별로 역할이 달라 이에 요구되는 인공뼈 부위에 기계적, 생리화학적 특성이 부합되어야 한다는 점이다. 이에 따라 생체친화성, 생체적합성(Bio-compatibility), 생체재생성(Bio-regeneration) 등의 용어가 중요하게 되었고 인체 내 뼈의 위치 및 상태, 목적에 따라 이에 맞는 인공뼈를 찾아서 시술하는 것이 임상과학의 주된 역할이다. 가장 손쉽게 많이 적용하는 시술이 자가골(Autogenous bone graft)을 일부 떼어내 원하는 부위에 시술하는 방법이다. 이밖에 다른 사람의 골을 채취하여 여러 방법으로 처리를 하여 제공함에 따라 시술해도 인체에 무해한 골이식재로 만들어 시판 중이고 이것이 가장 일반적이다. 이러한 경우 수요에 비해 공급이 제한적일 수밖에 없다. 이러한 인공뼈의 수요를 맞추기 위해 1세대 합성골로 앞의 HA/COL 나노복합체의 개발과 함께 콜라겐 보다 가격이 매우 싼 젤라틴(Gelatin, GEL)을 활용한 HA/GEL 나노복합체를 개발하게 되었다. 무기질(HA)과 유기물인 단백질(GEL)간의 유기-무기복합체 개발에서 유무기상호작용(Organic-inorganic interaction을 이해하고 바탕을 닦는 연구가 많이 이루어져 왔다. HA-COL6-10) 및 HA-GEL12)나노복합체 제조만으로는 생체 내에서의 골 신진대사(Bone metabolism)로 이루어지는 생화학 조건을 맞추기 어렵고 이에 따라 생체친화성 고분자를 활용한 인공뼈 수식(modification)에 관한 연구가 이루어져왔다13,14). 이러한 인공뼈 연구로 생체뼈가 요구하는 성질에 어느 정도 부합한 제품이 만들어져 오고 있다. 궁극적으로는 제 2세대 인공뼈로 생체재활성(Bio-regenration)이 있는 인공뼈 시스템이 연구개발 되고 있다15).
2. 생체모방과학과 유무기복합체
2.1인공뼈의 제조반응기설계
그림 1에서 보듯이 인체뼈는 뼈성분을 생성시키는 골아세포(Osteoblast cell)와 뼈성분을 파괴하는 파골세포(Osteoclast cell)로 이루어져 있고, 세포 내에서의 신진대사에 의해 뼈생성과 뼈소멸이 동시에 일어난다4). 인공뼈 제조화학에는 그림 2에서 보듯이 뼈생성세포인 골아세포에 의한 신진대사화학(Metabolic chemistry)을 일부 모방하여 만들어 왔다. 여기서 반응기로는 파이렉스 유리 비이커를 사용하거나 테프론코팅 스텐레스 용기를 사용한다11,12,15). 1세대 모방공학에서는 그림 2A에서처럼 인산칼슘결정의 원료화합물로 Ca(OH)2내지 CaCl2, 그리고 H3PO4를 이용하여왔고 콜라겐이나 젤라틴을 인산화시켜 침전물을 얻었다. 이후 그림 2B에서 보듯이 자유칼슘이온 및 인산의 이온화도에 따른 아인산 내지 차아인산을 얻기 위해 이온교환막을 이용한 시스템을 구성하였다.
인공뼈는 단백질원으로 콜라겐 혹은 젤라틴을 사용하고 이 단백질분자구조에 무기질 결정인 수산화아파타이트(HA, hydroxyapatite) 나노결정이 석출되게 한다. 이를 뼈과학에서는 광물질화(Mineralization) 혹은 석회화(Cal-cification)라 한다. HA의 결정화학식이 Ca10(PO4)6(OH)2로서 주요성분인 Ca2+이온이 콜라겐 단백질의 결정성분으로 결합되게 되어 있다. 인체 내에서는 소화과정을 통해 흡수된 Ca2+이온이 세포막을 통해 골세포 내로 흡수되어 뼈생성을 돕게 된다. 생체세포 내에서는 효소 및 이온통로 조절에 의해 이러한 반응이 이루어지나 공학적 설계에서는 효소를 사용하지 않는 화학공정반응으로 아파타이트 결정이 석출하는 공정으로 이루어지고, 석출물은 석회화 매체인 콜라겐이나 젤라틴 분자표면에서의 화학반응으로 결합하여 달라붙게 된다. 그림 2의 이러한 화학반응설계도에서 반응온도는 체온과 유사한 38℃도 고정하여 반응을 진행시킨다. 여기서 사용하는 물질전달장비 및 도구는 실제 병원에서 수혈 등에서 사용되는 의료용 펌프(Masterflex pump)와 실리콘 관을 활용한다. pH 미터, 펌프, 반응기 온도 등을 반응프로그램에 따라 자동으로 조절할 수 있게 장치를 꾸민다. [Ca2+]와 [PO43-]의 pH 및 온도에 따른 상평형도에 따라 원하는 결정상이 만들어지도록 한다16,17). 이상의 시스템을 세밀하게 꾸미고 주기적으로 pH미터, 반응기, 펌프, 실리콘관 등을 보수하여야 한다.
그림 2A는 제일세대 반응기 시스템이고 실제 세포와 유사한 반응기 시스템을 목표로 하여 세포막을 대신하는 이온교환막을 사용하는 제2세대 반응시스템을 도입하였다15). 이는 1세대의 경우 티타늄 임플란트처럼 인체뼈의 대체만을 목표로 개발되어왔고 2세대에서는 임플란트로 대체된 후 인체뼈 신진대사로 인체뼈로의 재생(Bio-rebeneration)을 목표로 하여 개발되었다. 그림 2B에서 보면 사각반응기의 중간에 격막을 두었는데 격막이 이온교환막으로 Ca2+ 및 PO43-의 자유이온을 얻기 위해 음이온 교환막과 양이온 교환막을 사용하는 전해투석반응(Electrodialysis)을 이용하는 시스템이다.
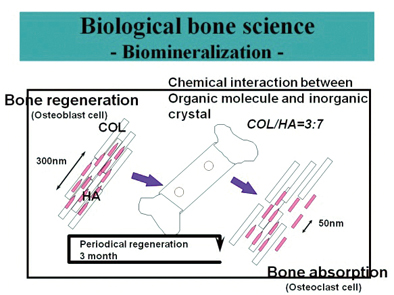
Fig. 1 인체뼈의 골형성 및 재생 개념도
골아세포와 파골세포에 의한 골신진대사에 의해 3개월 주기로 뼈의 재생
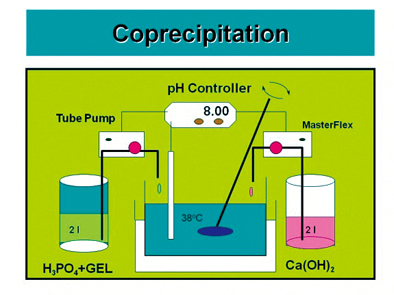
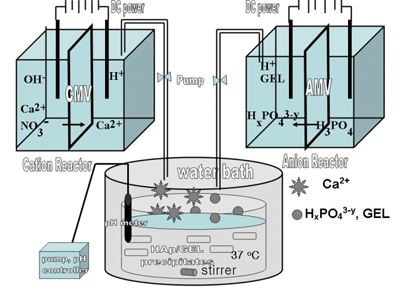
Fig. 2 (A) 생체모방공학을 응용한 HA/COL 나노복합체 석출반응개념도, (B) 교환막을 통한 자유이온 형성 및 농도 조정을 이용하는 HA/GEL나노복합체 제조개념도
2.2 인공뼈 제조화학
공침법을 이용하여 수산화아파타이트/(젤라틴, 콜라겐) 나노복합체를 제조한다. 제조에 있어 콜라겐이나 젤라틴 단백질 농도가 높으면 미세한 아파타이트 나노결정의 단백질 복합체가 얻어지고 농도가 낮으면 아파타이트 결정크기가 커진다. 아파타이트 나노결정이 콜라겐이나 젤라틴 분자의 C축을 따라 배열하여 달라붙어있다. 이는 인체뼈에서의 콜라겐-HA 결정구조와 유사하다. 칼슘이온농도와 인산이온농도를 일정하게 유지하는 수용액계에 용해되어있는 단백질의 농도는 아파타이트 결정의 핵생성 및 발달을 위한 불균질 핵생성 위치를 제공하는 중요한 역할을 한다. 콜라겐 농도가 높아지면 칼슘이온(Ca2+)에 대한 핵생성을 위한 활성화 위치를 많이 제공하게 되며 이는 핵생성 위치에 대한 칼슘이온농도가 상대적으로 낮아짐을 의미 한다 11,18-26). 아파타이트를 제조하기 위한 칼슘원으로 탄산석회(CaCO3)를 머플로 중에서 1150℃로 세시간 정도 하소한 후 냉각하여 3배수의 증류수를 첨가하여 수산화시켜 수산화칼슘(Ca(OH)2을 제조한다. 이 수산화칼슘을 120℃에서 두시간 건조하여 건조무게를 단 후에 수산화칼슘 중의 칼슘양을 결정하여 사용한다11).
하소반응은 다음과 같다.
1150℃
CaCO3 = CaO + CO2(1)
얻어진 생석회에 물을 첨가하여 수산화칼슘을 얻는다.
CaO + H2O = Ca(OH)2(2)
인산과의 공침반응 이전에 증류수 1리터에 소정량의 수산화칼슘분말을 넣고 교반하여 자유칼슘이온(Free Ca2+)를 만들어둔다.
Ca(OH)2 + H2O = Ca2+ + OH-(3)
아울러 인산과 젤라틴을 서어 교반하여 젤라틴을 인산화시킨다.
H3PO4 + H2O = H2PO4 + HPO4 + PO4 + OH-(4)
H3-xPO4-x + GEL = phosphorylated gelatin
다른 한편 콜라겐의 경우는 콜라겐제조공정에서 인산화 되어있는 콜라겐을 공급받아 사용한다. 이 경우 공급받는 콜라겐 용액의 pH 및 콜라겐농도 등을 기재하게 된다.
이상과 같이 만들어진 칼슘이온의 슬러리와 인산화젤라틴의 슬러리 각각을 펌프를 이용하여 38℃, pH=8에서 공침이 되도록 작동을 시킨다. 물 2리터에 수산화칼슘 0.1995몰을 용해시킨 석회유와 5g의 콜라겐을 용해시킨 인산수용액(아테로콜라겐) 59.7mM을 7리터 크기의 반응용기에 자동 pH제어기 및 자동모터펌프를 사용하여 동시침전 시킨다. 공침반응이 끝난 후 38℃ 에서 12시간 동안 숙성시키고 이때의 pH는 공기 중 탄산가스 흡수로 7.0까지 떨어진다.
재조예로서는 젤라틴의 경우 수산화칼슘과 인산의 첨가량을 수산화아파타이트(HA, Ca10(PO4)6(OH)2)양이 10g이 되도록 한다. 젤라틴3g 내지 5g을 인산과 혼합하여 수용액으로 만들고 2리터 용액에 앞서 만든 석회유를 각각 펌프로 이송하여 반응조에 떨어뜨려 침전시킨다. 반응종료 시 총 부피는 4리터가 된다. pH 8.8, 38℃ 에서 반응시키고 침전반응 후 12시간 동안 숙성시킨 후 침전물을 얻는다. 이렇게 하여 만들어지는 HA/COL 나노복합체는 그림3과 같은 나노구조로 이루어지는 것으로 생각된다. 여기서 Ca(OH)2수용액의 활성도와 교반으로 자유 Ca2+이온이 만들어지는 반응속도에 따라 균질핵생성(A-type)과 불균질핵생성(B-type)이 이루어지는 것으로 짐작되며 이에 따라 인산화 젤라틴과 자유 칼슘이온 효과적인 유무기상호작용을 달성하기 위해서는 반응, pH, 온도 등을 세밀하게 제어하는 것이 중요하다.
2.3 스캐폴드(Scaffold) 제조
숙성하여 만들어진 슬러리를 일부 채취하여 투과전자현미경(TEM, JEM-1210, JEOL Japan)으로 상분포, 이자형상 및 크기 등을 관찰하고 실제 뼈에서의 구조적 차이를 비교한다. 일부 침전은 유리필터로 여과시켜 이온교환수로 5번 세정한다. 만들어진 복합체시료 케이크를 공기 중 자연건조시킨다. XRD, FT-IR등을 사용하여 상분포(XRD, Siemens 5005, Germany)및 유기-무기질간 상호작용(FT-IR, Magna 750R, Nicolet, USA)을 조사한다.
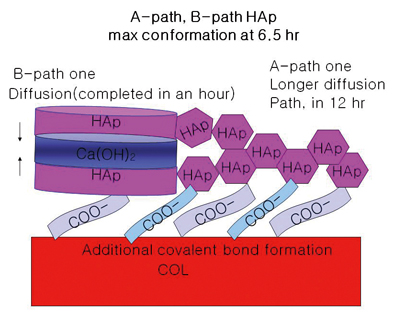
Fig. 3 그림 2의 반응개념도 I에 따라 만들어지는 HA/COL나노복합체 생성개념도.
젤라틴 분자에서의 HA결정의 균질핵생성과 불균질 핵생성 개념
2.4 생체적합성
만들어진 시편을 이용하여 생체적합성을 테스트 한다. 순차적으로 세포실험과 동물실험 등을 거친다27-29). 인공뼈 시편의 세포실험 및 동물실험은 연구개발목적에 따라 각기 정해진 실험과정을 따라 시행한다. 한 예로 골수세포(bone marrow)를 이용한 세포실험으로서 골수세포는 수많은 경로로 분화할 수 있는 세포 들이 밀집해있는 것으로서, HA/GEL 시편상에서 토끼골수 줄기세포(stem cell)의 골생성세포의 분화 및 증식을 통한 실험이다. 그림 4에서 보듯이 쥐의 대퇴골를 이용한 동물실험에서 10주일 후 이식한 HA/GEL 시편이 생체뼈와 융합되어가는 모습을 보여주었다.
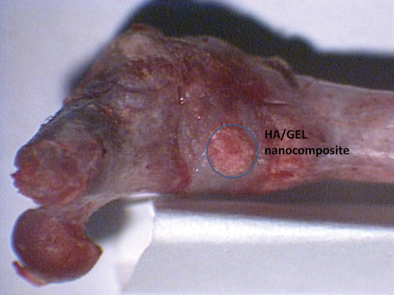
Fig. 4 HA/GEL 나노복합체 시편의 동물이식실험 . 주의 엉덩이뼈에 HA/GEL 나노복합체
시편을 이식한 후 10주 후의 생체뼈와 융합된 인공뼈를 보여준다.
3. 인공뼈와 유기무기상호작용
3.1 HA/COL 나노복합체
그림 5에서 보듯이 HA/COL 나노복합체 시료의 유기무기상호반응에 만들어진 HA/COL 나노복합체의 유기무기상호작용을 조사한 결과 다음과 같다6-10). HA/COL나노복합체 시료에 대한 FT-IR결과 인체뼈에서의 치밀골인 코티칼본(Cortical bone)의 결과(Boskey)와 아주 유사하였다4,30). 구체적인 특성으로는 가장 중요한 성분인 인산염기가 900-1200cm-1 영역에서 나타났고 ν1, ν3 PO4 진동이 이에 속한다. 이 진동수 범위는 뼈의 무기질화 정도를 가늠하는 척도로 사용되기도 한다. 이밖에 1100-1800cm-1 영역에서의 콜라겐 단백질에 기인하는 아미드 I, II, III기가 나타난다. 수산기에 대한 대표진동모드가 3568cm-1에서 나타나고 탄산기에 대한 ν2 모드가 879cm-1에서 나타난다.
이러한 합성법으로 만들어지는 나노복합체는 공정과정에서 공기중의 탄산가스를 흡수해 탄산화한다31). 일반적으로 탄산기는 OH-기(A형) 및 PO43-기(B형)을 치환하는 것으로 알려져 있다. A형은 1453cm-1,1420cm-1밴드에 해당한다. 합성 나노복합체로 만든 인공뼈는 뼈성분중 탄산이 아파타이트의 수산기 및 인산기 모두에 상당량 치환하여 형성되었음을 알 수 있다. 무기결정인 HA와 유기물인 콜라겐 사이의 유기-무기결합 특성은 화학결합에 의한 콜라겐의 1339cm-1밴드의 화학편이(chemical shift)로 부터 평가될 수 있다. 그림 4C에서 유기무기화학결합이 증가하면 밴드가 낮은 주파수로 아동하고 이는 아파타이트의 칼슘이온과 콜라겐의 관능기인 카복실기의 결합으로 1339cm-1밴드의 진동이 느려짐에 따른 것이다. 일반적으로 1339cm-1 밴드는 콜라겐 분자 중 프롤린(Proline) 측쇄에 붙어있는 CH2의 흔들림(wagging) 진동에 의해 크게 영향을 받는 것으로 알려져 있다. 이 흔들림 모드가 Ca2+-COO- 간의 배위결합에 의해 영향을 받고 있는 것임을 알 수 있다. 이 배위결합은 공유결합에 약간의 이온결합특성이 혼합되어있는 것으로 생각되는 비교적 강한 화학결합을 하는 것으로 알려져 있다.
Fig. 5 HA/COL 나노복합체의 유무기상호작용의 해석을 위한 FT-IR 스펙트럼--<생략>
3.2 HA/GEL 나노복합체
그림 6A에서 HA/GEL 나노복합체 시편의 FT-IR 스펙트럼이 인체뼈4)와 HA/COL 나노복합체의 FT-IR 스펙트럼과 아주 유사하다11-21). 대표적인 피크로는 OH-피크로서 3568cm-1, CO3 ν2 로서 879cm-1, PO4 ν1, ν3 피크, 아미드 피크 등이 실제뼈와 유사하다. 원료인 젤라틴의 FT-IR 스펙트럼은 1691cm-1, 1559cm-1에서 각각 아미드 I, II 피크를 보인다. 수산화아파타이트(HA)는 950-1200cm-1스펙트럼 영역에서 대표적인 특성피크를 보인다. HA/GEL 나노복합체에서의 아미드 I이 1664 cm-1에 나타나는 것은 만들어진 나노복합체가 α형 나선배열구조를 택하고 1537cm-1에 위치하는 아미드 II로 부터도 이를 확인할 수 있다. HA/COL 나노복합체에서 보듯이 젤라틴 양에 따라 1339cm-1밴드의 적색편이(red-shift)가 일어남을 알 수 있다. 젤라틴 양이 많을수록 밴드전이가 적어진다. 20g정도 에서는 HA나노결정의 유기무기결합에 의한 1339cm-1 밴드편이가 거의 없다.
콜라겐에서의 1339cm-1 밴드는 단순히 카복실기를 대표하는 것은 아니고, 생체조직에서의 I형 콜라겐에 기인하는 1400 – 1260cm-1 스펙트럼 영역에서의 여러 밴드 중 하나다. 특히, 콜라겐에서 1339cm-1밴드는 프롤린 측쇄의 흔들림 진동(wagging vibration)에 주로 기인한다. 이 밴드는 HA/GEL 복합체에서도 같게 나타나고 이러한 밴드편이는 젤라틴의 프롤린 측쇄가 수산화아파타이트 나노결정에서의 Ca2+이온과 공유결합형성함에 따라 흔들림 진동이 크게 영향을 받는 것으로 믿어진다. pH7 이상에서 젤라틴의 카복실기는 큰 이온성을 가져 Ca2+이온에 대해 이온결합위치로 작용하게 된다. HA 나노결정은 젤라틴 거대분자에 결합할 때 선택적 방향성을 갖고 발달하게 되며 젤라틴 양이 많아지면 방향성결합의 양이 감소하게 된다. 이점이 콜라겐을 매체로 이용할 때와 크게 다르다. 젤라틴을 추출할 때 소뼈나 돼지피부의 콜라겐 조직을 화학적 혹은 가열반응으로 열화(degradation)시켜서 분리해 내게 된다32,33).
이에 따라 젤라틴은 거대분자조직인 콜라겐의 분해된 조직이라 할 수 있고 여기에 결합되는 HA 나노결정은 아주 미소단위부분의 GEL 분자 내에서만 선택적 방향성을 갖게 된다. 이로부터 제조되는 HA/GEL복합체의 슬러리 페이스트 특성이 HA/COL복합체와는 사뭇 다르게 된다. 즉, 나노구조로는 큰 차이는 없으나 미크론 단위 이상의 거대구조로는 커다란 복합체원료 특성을 보인다. 이러한 유기무기반응에 있어서 카복실기에 결합되는 HA결정형태가 비정질로 부터 미성숙결정을 거쳐 성숙된 나노결정에 이르기 까지 다양한 형태의 인산칼슘을 보여주게 된다. 1339 cm-1밴드의 전이가 적을 경우는 GEL 분자와 결합되는 HA의 결정크기가 작을 때로 프롤린 사슬의 흔들림 진동에 의한 에너지 손실이 적다는 의미이다. 이러한 특성은 그림 6D에서 보듯이 투과전자현미경(TEM)이나 전자선회절(ED)로 관찰이 어려울 때 결합특성을 이해하는데 커다란 도움이 된다.
인체에서의 아파타이트는 유기거대분자인 콜라겐 수용액 중에서 HA의 핵생성 및 결정성장이 일어나 유기-무기복합체가 형성되는 것으로 이를 보통 유기아파타이트(Organic apatite) 혹은 생리적 아파타이트(Biological apatite)라 부른다. 이들 아파타이트 입자는 콜라겐 거대분자 자체가 갖고 있는 자기조직화(self-organization) 반응 및 자기조립화(self-assembly)에 의해 뼈구조가 형성되는 것이다. 젤라틴 분자의 이 같은 화학결합능력은 콜라겐의 열화과정으로 약화되지는 않는다. 즉, 밴드의 화학적 편이가 HA/GEL복합체에서 여전히 크다는 의미이고 HA/COL 복합체와 별 차이가 없다. 단지, 두 단백질의 차이는 자기조직화 내지 자기조립화 능력에 차이가 있어 뼈시료와 같이 거대구조형성에 있어 두 방법에 큰 차이가 있게 된다. 즉, HA/GEL 복합체는 마크로 구조에서 장거리 네트워크를 형성하는데 어려움이 있게 된다. HA/COL 복합체의 거대분자가 자체가 갖는 자기조직화 현상 때문에 뼈스캐폴드를 구성하는 토대를 형성하는데 유효하나 실제 인체뼈에서는 이밖에 여러가지 콜라겐이 사용된다. 즉, I형 콜라겐만을 사용하여 위의 공침반응을 통한 시료를 만들게 될 때 나노구조상으로는 인체뼈와 유사하나 HA/COL 페이스트를 이용하여 뼈시편을 만들게 되면 강도가 아주 약하면서 골세포가 활동할 공간을 위한 기공을 조절하기도 쉽지 않다. 건조강도는 더욱 약해진다. 인체뼈의 경우 II, III, IV형 등의 콜라겐이 일부 포함되어 이를 보완하게 된다. 이 같은 목적을 위해 IV형 콜라겐 등을 포함시켜 복합체를 만든 경우도 있지만 궁극적으로 생체뼈를 대체할 수 있는 소재가 되기는 힘들다.
한편 HA/GEL복합체에는 다양한 콜라겐원료가 포함되어있고 반응성이 좋아 강도가 좋은 시편을 만들 수는 있으나 세포가 들어가 활동만큼의 기공을 만들어야 하고 수분함량에 따라 건조 및 가습 등으로 파괴되어버리는 단점을 보완하여야 한다. 이를 공학적 설계공정으로 만들기 위해서 생체적합성 폴리머를 이용하여 변성시키게 된다. 사용되는 고분자원료로는 PVA, PAA등의 바이오급 고분자를 사용하여 젤라틴 단백질과의 결합내지 변성을 시킨다.
Fig. 6 HA/GEL 나노복합체의 유무기상호작용의 해석을 위한 FT-IR 스펙트럼 --<생략>
(A) (B) (C) (D)
(D) 투과전자현미경 사진으로 인체뼈에서의 결정구조와 매우 유사하다.
3.3 HA/GEL의 고분자수식 복합체
사용되는 고분자원료로는 PAA, PVA등의 바이오급 고분자를 사용하여 젤라틴 단백질과의 결합내지 변성을 시킨다13,14). 인체뼈와 유사한 기계적 성질을 갖고 경조직(hard tissue)의 기능을 보여주는 HA/GEL 복합체를 만들기 위해 바이오폴리머로 수식하여 자가골(Autogeneous bone)을 대치할 수 인공뼈를 목표로 한다. HA/GEL 복합체를 만들 때 젤라틴 분자는 HA결정으로 자기조직화하는 능력을 부분적으로 갖고 있으며 유기-무기반응 후에 석회화되지 않고 자유젤라틴이 일부 잔류하여 최종 복합체 사이에 고분자 접착제로서 작용한다. 자유젤라틴은 복합체의 강도를 높여주게 되나 단점은 복합체의 건조과정 중에 균열발생의 원인이 되고 있다. 수분이 존재할 때는 복합체 시편에서 생성되는 이방성 치수변화로 인해 응력이 발생하고 이 응력은 자유젤라틴 고분자에서의 자유수가 갖는 가소성으로 흡수되게 된다. 최종적으로 건조될 경우 응력을 흡수할 수 있는 자유수 내지 가소성 고분자가 없어져 균열발생이 나타나게 된다. 액상젤라틴은 건조 시 스트레인을 흡수하지 못하고 쉽게 균열이 발생하는 특징이 있다. 이 같은 스트레인을 흡수할 버퍼재로 수식하여 발생되는 스트레인을 흡수하게 되며 이에 적합한 재료로는 PVA, PAA 등을 사용하게 된다. 이같이 HA/GEL 나노복합체를 수식하는 방법으로는 위의 고분자수용액에 HA/GEL 복합체슬러리를 분산시키는 방법과 다른 방법으로는 수용성고분자와 HA의 나노복합체를 만들고 이를 HA/GEL복합체와 혼합시켜 물성변화를 주는 방법이다.
1) HA/PAM 나노복합체
액상 PAM고분자 원료를 증류수에 녹이고 30분간 교반한 후 인산을 첨가하여 혼합한다. 이 PAM-인산 혼합용액과 다른 한편으로는 석회유를 자동펌프로 정량을 보내 혼합시키면서 HA/PAM 나노복합체를 만든다. 만들어진 슬러리를 진공필터로 여과세정하여 시편을 만든다14). 그림 7A에서 전자현미경과 전자선회절 분석으로부터 PAM 분자에도 유기무기상호작용에 의한 Ca2+-COO- 결합으로 아파타이트 나노결정 복합체가 이루어짐을 알 수 있다.
마크로 복합체 - HA/GEL 과 HA/PAM 나노복합체로 부터 만들어진 HA/GEL과 HA/PAM 나노복합체 슬러리를 혼합 및 교반한다. 섞인 슬러리를 여과세정하여 시편을 만들어 얻어진 복합체를 냉장고에 보관하여 필요한 만큼 시료형상 및 크기로 만들어 건조시킨다.
2) 조대복합체에서의 유기-무기 상호작용
그림 7B,C에서 PAM에서의 특정밴드에는 3340 -3200cm-1영역의 아미드 A밴드로 N-H ν밴드가, 2942cm-1와 2778cm-1에 있는 CH2 ν밴드, 1660 과 1612에 있는 C=O ν밴드, 1451cm-1에서의 CH2 δ밴드, 1414cm-1에서의 –C-H 밴드 등이 있다. HA/PAM 시료에서는 1454cm-1및 1420cm-1에서의 특성밴드를 보여주는 데, 이는 HA결정에서의 OH- 밴드에 공기 중 CO2 흡수로 전이가 일어난 것이다14). 또한 1325cm-1 밴드는 유기무기상호작용을 보여주고 있다. 1669cm-1 와 1618cm-1에서 보여주는 아미드 I밴드는 PAM분자들 사이의 상호작용을 보여주고 1325cm-1에서의 Ca-COO 복체밴드는 HA와 PAM 분자사이의 유기무기상호작용을 보여준다. HA 와 PAM 사이의 유기무기상호작용은 1800-1500cm-1 영역에서의 유기밴드와 1200-900cm-1 영역에서의 PO4 밴드로부터 알 수 있다. 1617cm-1과 1616cm-1 밴드는 HA와 PAM간의 유기무기상호작용에 의해 형성됨을 뜻한다. 1032cm-1 밴드로부터 좋은 양론성을 갖는 HA결정이 발달하고 있음을 뜻하고, 1020cm-1밴드는 비양론성 아파타이드 결정이 발달함을 뜻하고 PO4 ν3밴드를 의미한다. 1150-980 cm-1 사이의 인산염 밴드 스펙트럼으로부터 볼 때 HA 결정과 PAM분자 사이의 유기무기상호작용이 비화학양론성 아파타이트 조성을 유도하고 있음을 뜻한다.
3) HA와 젤라틴 분자간의 유기-무기 상호작용
스펙트럼으로부터 볼 때 HA 결정과 PAM분자 사이의 유기-무기상호작용이 비화학양론성 아파타이트 조성을 유도하고 있음을 뜻한다. 인산수용액 중에서의 젤라틴의 열화로젤라틴의 아미드 밴드가 수식되고 PO4밴드가 발생한다. 3312cm-1의 아미드 A밴드는 3370cm-1 밴드로 청색편이(blue-shifted)된다. 젤라틴의 인산수용액 중 열화현상으로 1700-1500cm-1사이에서 아미드 I, II 밴드가 나타난다21). 아미드 I, II밴드의 스펙트럼 형상은 열화로 수식이 된다. 이밖에 아미드 I, II 밴드의 주파수는 거의 편이 되지 않는다. 젤라틴 분자의 프롤린기에 해당하는 1339cm-1 밴드는 Ca2+-COO- 결합으로 그 뒤틀림 진동결합이 1335 cm-1로 적색편이(red-shifted) 한다. 인산수용액 중 젤라틴분자의 열화로 PO4 ν3모드가 1115cm-1 에서 1111cm-1로 적색편이 하게 된다.
한편 PO4 ν1 모드는 964cm-1에서 960cm-1 모드로 편이 한다. 아미드A밴드는 젤라틴의 인산화로 청색편이하게 된다. 젤라틴은 콜라겐에 비교해 아미드 A밴드가 청색편이(25-30cm-1)하고 이는 젤라틴 제조시 가열화학처리로 손상되는 콜라겐구조의 정도를 보여주는 것이다. 이로 인해 젤라틴은 유기무기상호작용을 위한 템플레이트(template)로서의 길이척도(length scale)가 줄어들게 된다. HA 결정과 GEL 매체 사이의 유기-무기상호작용은 강한 아미드 I, II 밴드의 존재로 확인할 수 있다. 유기-무기상호작용의 양은 젤라틴의 열화로 감소해가고 또 다른 증거로는 1335cm-1에서의 Ca2+-COO-의 스펙트럼 형상으로 확인할 수 있다. 사면체PO4밴드에서 ν1, ν3는 H3PO4의 삼염기산(triprotic acid)의 효과를 보여준다. 여기서 902cm-1은 HPO42-기의 화학적 배위를 보여준다. 젤라틴의 열화에 따른 인산칼슘(Ca-P, Calcium Phosphate)상의 형성과 유기무기상호작용 사이의 반응경쟁이 있다.
Fig. 7 HA/GEL과 HA/PAM 마크로 복합체 형성. (A) PAM농도가 높을 때의 PAM의 석회질화를 보여준다. (B,C) 마크로복합체의 유무기상호작용의 해석을 위한 FT-IR 스펙트럼--<생략>
4. 맺음말
인공뼈 제조를 인체모방공학으로 만들 때 뼈성분인 수산화아파타이트의 결정화를 석회화 매체인 콜라겐 내지 젤라틴 분자의 젤라틴의 인산화에 의해 민감하게 영향을 받고 궁극적인 인체뼈를 대체하기 위해서는 바이오고분자로 수식하는 데 이때 유기물인 젤라틴, 수식고분자의 선택이 중요하고 아파타이트 원료물질인 칼슘이온의 합성 및 공정조절, 젤라틴 및 유기고분자의 인산화 공정 등이 세밀하게 제어되어야 거대분자의 조직구조를 갖는 인체뼈의 대체재료로 만들어지게 된다. 대체된 소재는 궁극적으로 인체뼈의 일부분이 되어 뼈의 재생이 가능해지는 재생뼈로의 기능을 가져야 함이 바람직하다.
참고문헌
1. R. A. Young, “Biological apatite vs. hydroxyapatite at the atomic level”, Clin. Orthopedics, 113, 249–60 (1975)
2. A. Ascenzi, GH Bell, “Bone as a mechanical engineering problem”, In: Bell GH, editor. The biochemistry and physiology of bone, vol. 1, p.311–52, New York: Academic Press; 1972.
3. S. Mann, D. D. Archibald, J. M. Didymus, T. Douglas, B. R. Heywood, F. C. Meldrum, J. R. Nicholas, “Crystallization at inorganic-organic interfaces: biomaterials and biomimetic synthesis”, Nature, 382 313–8 (1993)
4. AL Boskey. “Will biomimetics provide new answers for old problems of calcified tissues?”, Cacif Tissue Int., 63 179–82 (1998)
5. S. I. Stupp, P. V. Braun, “Molecular manipulation of microstructures:biomaterials, ceramics, and semiconductors”, Science, 277 1242–8 (1997)
6. M. C. Chang, T. Ikoma, M. Kikuchi, J. Tanaka, “The Cross-Linkage Effect of HA/Collagen Nanocomposite on a Self-Organization Phenomena”, J. Mat. Sci., Mat. Med.,13, 993-997 (2002)
7. M. C. Chang, J. Tanaka, “XPS study for the microstructure development of HA/COL nanocomposite cross-linked using glutaraldehyde”, Biomaterials, 23, 3879-3885 (2002)
8. M. C. Chang, J. Tanaka, “FT-IR Study for HA/COL nanocomposite cross-linked by glutaraldehyde”, Biomaterials, 23 4811-4818 (2002)
9. M. C. Chang, “Heterogeneous nucleation of HA/COL nanocomposite”, J. Kor. Ceram. Soc.., 38(11), 498-504 (2001)
10. M. C. Chang, T. Ikoma, M. Kikuchi, J. Tanaka, “Preparation of a porous HA/COL nanocomposite using glutaraldehyde as a crosslinkage agent”, J. Mat. Sci., Lett, 20(13), 1199-2001 (2001)
11. M. C. Chang, C-C. Ko, W. H. Douglas, “Preparation of HA-GEL nanocomposite”, Biomaterials, 24(17) 2853-2862 (2003)
12. M. C. Chang, C-C. Ko, W. H. Douglas, “Conformational Change of HA/GEL nanocomposite by glutaraldehyde”, Biomaterials, 24 3087-3094 (2003)
13. M. C. Chang, C-C. Ko, W. H. Douglas, “Modification of HA/gelatin composite by polyvinylalcohol”, J. Mat. Sci., Lett, 40(1) 505-509 (2005)
14. M. C. Chang, U-K Kim and W. H. Douglas, “Modification of HA/GEL nanocomposite using polyacrylamide”, Journal of Biomaterials Science, 20 363–375 (2009)
15. M. C. Chang, Ralph DeLong, “Calcium phosphate formation in gelatin matrix using free ion precursors of Ca2+and phosphate ions”, Dental Materials, 25 261–268 (2009)
16. W. E. Brown, L. C. Chow, “A new calcium phosphate water-setting cement, in Cement Research Progress”, pp.351-379, P. W. Brown (Ed.), The American Ceramic Society, Westerville, Ohio, 1986,
17. L. C. Chow, “Development of self-setting calcium phosphate cements”, J. Cer. Soc. Japan, 99 954-64 (1991)
18. M. C. Chang, C-C. Ko, W. H. Douglas, “Fluoride incorporation in HA/GEL nanocomposite”, J. Mat. Sci., 40 2723-2727 (2005)
19. M. C. Chang, W. H. Douglas, J. Tanaka, “Organic-inorganic interaction and the growth mechanism of HA crystals in gelatin matrices between 37 and 80oC”, J. Mat. Sci. in Med, 17 387-396 (2006)
20. M. C. Chang, Fluoride incorporation in HA/GEL nanocomposite, J. Mater. Sci:Mater. Med., 19 2837–2843 (2008)
21. Myung Chul Chang, “Organic–inorganic interaction between HA and gelatin with the aging of gelatin in aqueous phosphoric acid solution”, J. Mater.S ci:Mater. Med., 19(11) 3411-3418 (2008)
22. M. C. Chang, T. Ikoma, J. Tanaka, “Cross-linkage of HA/GEL nanocomposite using EGDE”, J. Mat. Sci., Lett, 39 5547-50 (2004)
23. M. C. Chang, “Molecular orbital calculation on the configuration of hydroxyl group in hexagonal HA”, J. Kor. Ceram. Soc., 42(5), 304-37 (2005)
24. M. C. Chang, “Morphology Development of HAp crystallites in GEL matrix”, J. Kor. Ceram. Soc., 44(3), 134-136 (2007)
25. M. C. Chang , W. H. Douglas, “Cross-linkage of HA/GEL nanocomposite using imide-based zero-length cross-linker”, J. Mater. Sci:Mater. Med., 18 2045–2051 (2007)
26. M. C. Chang, ”Modification of HA/GEL nanocomposite with the addition of chondroitin sulfate”, J. Kor. Ceram. Soc., 45(10) 573-578 (2008)
27. D-S Hwang, U-K Kim, M. C. Chang, Y-D Kim1, S-H Shin1 and I-K Chung, Osteogenic differentiation of stem cells in a HA/gelatin nanocomposite, J. Tissue Engineering and Regenerative Medicine, 6 (12) 1107-1113 (2009)
28. H-J Jeon, Y-S Hwang, U-K Kim, D-S Hwang, K-H Lee, M. C. Chang, “Osteogenic differentiation of bone marrow derived stem cells in HA/GEL nanocomposite”, J. Kor. Oral. Maxillofac. Surg., 35(1) 7-12 (2009)
29. M. C. Chang MC, C. C. Ko, C. C. Liu, W. H. Douglas, R. DeLong, W. -J. Seong, J. Hodges J, K. -N. An, “Elasticity of Alveolar Bone near Dental Implant-Bone Interfaces after One Month’s Healing”, J. Biomech., 36 1209-14 (2003)
30. E. P. Paschalis, E. DiCarlo, E. Betts, P. Sherman, R. Mendelsohn, AL Boskey, “FT-IR microspectroscopy analysis of human osteonal bone”, Calcif. Tissue Int., 59 480–7 (1996)
31. A. H Touny, C. Laurencin, L. Nair, H. Allcock and P.l W. Brown, “Formation of composites comprised of calcium deficient HA and cross-linked gelatin”, J. Mater. Sci: Mater. Med., 19 3193–3201 (2008)
32. AG Word, A. Courts, “The science and technology of gelatin”, London: Academic Press, 1977.
33. A. Veis, “The macromolecular chemistry of gelatin”, London: Academic Press, 1964.
 장 명 철
장 명 철
- 1973~1979년 서울대학교 재료공학과 학사
- 1990년 서울대학교 공과대학 무기재료공학과 박사
- 1994년 일리노이주립대학교(UIUC) 재료공학과 포스트닥
- 2000년 미네소타주립대학교 치과대학 3M연구센터(MDRCBB)
- 1991~현재 군산대학교 신소재공학전공 교수
<본 사이트는 일부 내용이 생략되었습니다. 자세한 내용은 세라믹코리아를 참조바랍니다.>
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net