리튬 이차전지용 전해액 연구개발 동향
이 호 춘 _ 대구과학기술원 교수
1. 전해액의 개요
리튬 이차전지 (이하 LIB)의 충전/방전 시, 외부 전기 전도체내에서의 전하이동은 전자이동에 의해 이루어지지만, 전기적으로 분리된 양극과 음극사이의 전하 이동은 리튬 이온이 담당한다. LIB용 전해액은 이러한 이온 이동이 일어나는 매체라 정의할 수 있다.
현재 “Electrolyte“에 해당하는 우리말은 전해질 혹은 전해액 두 용어가 서로 명확히 구분되지 않은 채 사용되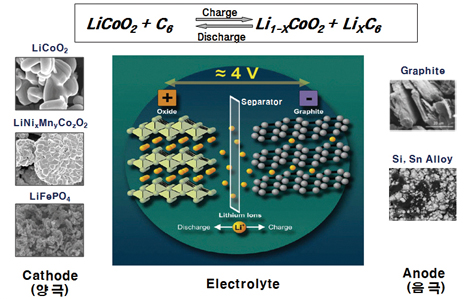 고 있다. 엄밀한 의미에서 Electrolyte은 전해질을 의미하며, 이는 용매에 용해되어 이온종을 형성할 수 있는 염(salt)을 의미한다. 용매는 액체, 고분자, 고체 및 이들의 혼용 형태를 가질 수 있다. LIB용 Electrolyte의 용매 종류에 따른 분류와 각각의 특성을 표 1에 정리하였다. 액체 형태의 Electrolyte은 리튬염을 유기 용매에 용해시킨 것으로, 현재 생산되고 있는 거의 모든 LIB에 적용되고 있다. 고체 고분자나 무기물전해질을 용매로 사용하는 고체 Electrolyte은 액체 타입에 비해 이온 전도도가 현저히 낮아서 실제 적용보다는 아직 기초연구 수준에 머물고 있다. 고체 고분자와 액체 용매의 하이브리드 형태의 용매를 사용하는 Gel polymer electrolyte은 그 물성이 액체 전해질과 고체 고분자 전해질의 중간적 특성을 보인다. 현재 시판되고 있는 리튬 폴리머 전지에 적용되고 있다. 이하에서는 현재 가장 널리 사용되고 있는 액체 형태의 Electrolyte (이하 전해액)에 대해 주로 다루기로 하겠다.
고 있다. 엄밀한 의미에서 Electrolyte은 전해질을 의미하며, 이는 용매에 용해되어 이온종을 형성할 수 있는 염(salt)을 의미한다. 용매는 액체, 고분자, 고체 및 이들의 혼용 형태를 가질 수 있다. LIB용 Electrolyte의 용매 종류에 따른 분류와 각각의 특성을 표 1에 정리하였다. 액체 형태의 Electrolyte은 리튬염을 유기 용매에 용해시킨 것으로, 현재 생산되고 있는 거의 모든 LIB에 적용되고 있다. 고체 고분자나 무기물전해질을 용매로 사용하는 고체 Electrolyte은 액체 타입에 비해 이온 전도도가 현저히 낮아서 실제 적용보다는 아직 기초연구 수준에 머물고 있다. 고체 고분자와 액체 용매의 하이브리드 형태의 용매를 사용하는 Gel polymer electrolyte은 그 물성이 액체 전해질과 고체 고분자 전해질의 중간적 특성을 보인다. 현재 시판되고 있는 리튬 폴리머 전지에 적용되고 있다. 이하에서는 현재 가장 널리 사용되고 있는 액체 형태의 Electrolyte (이하 전해액)에 대해 주로 다루기로 하겠다.
2. LIB용 전해액의 구성 성분
LIB용 전해액의 구성성분은 크게 리튬염, 용매, 그리고 첨가제 세 가지로 구분할 수 있다. 리튬염과 용매 두 성분만으로도 LIB용 전해액의 가장 근본적인 역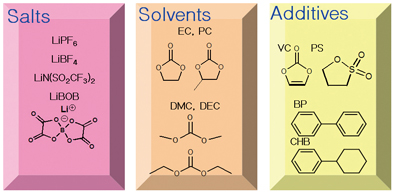 할인 Li+ 이온 전도가 가능하다. 그러나 현재 대부분의 LIB는 부족한 특성을 보완하기 위한 기능성 전해액 첨가제를 사용하고 있다.
할인 Li+ 이온 전도가 가능하다. 그러나 현재 대부분의 LIB는 부족한 특성을 보완하기 위한 기능성 전해액 첨가제를 사용하고 있다.
2.1 유기용매
현재 상용 LIB에 사용되고 있는 용매는 대부분 carbonate계 화합물이며, 이들의 기본적인 물성을 표 2에 나타내었다. 일반적으로 cyclic carbonate는 고유전율/고점도의 특징을 보이는 반면, linear carbonate는 저유전율/저점도를 나타낸다. 유전율이 높을수록 리튬염의 용해/해리 측면에서 유리하지만, 점도는 낮을수록 이온의 mobility 관점에서 바람직하다.
따라서 거의 모든 LIB용 전해액은 cyclic carbonate와 linear carbonate 각각 1종 이상의 혼합 용매를 사용한다. 각 carbonate의 종류와 혼합비에 따라 전해액의 특성이 크게 영향을 받는다. 최적의 용매 조합은 LIB 설계자 각자의 요구 사항에 따라 달라질 수 있다. 용매의 안정성, 저온 특성, 안전성을 보완하기 위해 carbonate계 전체 또는 일부를 비 carbonate계인 ester, phosphate계 신규 용매로 대체하려는 시도들이 활발히 진행되고 있다. 하지만 아직까지 상업적 성공 사례는 매우 제한적인데, 이에 대한 주된 이유 중 하나는 이들 화합물들이 흑연계 음극에서 문제를 발생시키기 때문으로 알려져 있다. 그러나 향후 비 흑연계 음극재료 개발에 따른 신규 용매의 필요성이 대두됨에 따라 이들 비 carbonate계 용매에 대한 재검토가 이루어질 것으로 예상된다.
2.2 리튬염
LIB용 전해액에 리튬 이온을 제공하는 중요한 역할을 한다. 표 3에 주요 리튬염들의 특성을 비교하였다. 리튬염의 특성은 음이온에 의해 크게 좌우된다. 일반적으로 음이온의 크기가 클수록 해리가 잘 되는 장점이 있는 반면, 전해액의 점도를 높이는 경향이 있다. LiPF6는 열적으로 불안정하며 미량의 수분과 반응하여 HF를 생성하고, 생성된 HF가 전지성능에 영향을 주는 단점이 있다. 그러나 이러한 단점에도 불구하고 높은 이온 전도도와 준수한 안전성 때문에 현재 대부분의 LIB용 전해액은 LiPF6를 채택하고 있다. 최근, 많은 연구자들이 LiPF6를 대체하기 위해 일부 F기가 알킬기로 치환된 염이나, 이미드계 혹은 붕소계 등의 신규염을 개발하기 위한 노력들을 하고 있지만 아직까지 성공적인 결과는 보고되지 않고 있다. LiPF6를 능가하는 대체물 개발은 그만큼 쉽지 않지만 성공할 경우의 파급효과는 상당할 것으로 예상된다.
2.3 첨가제
이온 이동이라는 주된 역할 이외에 전지의 부족한 성능을 보완하거나 안전성을 향상시키는 등의 부가 기능이 더해진 전해액을 기능성 전해액 (functional electrolyte) 이라 한다. 기능성 전해액은 전지 개발자에게 있어서 매우 매력적인 옵션인데, 이는 전극 활물질과 달리, 전지 설계 수정이라는 부담을 최소화하며 손쉽게 변경이 가능하기 때문이다. 기능성 전해액을 구현하는 주된 방법은 적절한 첨가제를 사용하는 것이다. 기능성을 갖는 용매나 리튬염을 사용하는 방법도 있겠지만, 용매와 염의 변경은 전해액의 물성 변화를 수반하게 될 뿐 아니라, 이들에 대한 선택의 여지 또한 많지 않다는 어려움이 있다. 기능성 첨가제의 경우 대개 전해액 전체 대비 수 % 정도의 소량만이 사용되므로 전해액 물성에 큰 변화를 주지 않으며, 또한 다양한 화합물들이 사용될 수 있는 장점이 있다. 따라서 기능성 전해액 첨가제는 관련 특허나 연구 논문 발표가 집중되는 활발한 분야이며, 그만큼 개발 경쟁이 치열한 분야이기도 하다. 다양한 기능성 첨가제가 존재하지만 이들의 작동 기작은 크게 두 가지로 분류해 볼 수 있다. 첫째는 전극/전해액 계면특성에 영향을 주는 첨가제인데 이들은 양극이나 음극 표면에서 전기화학적 혹은 물리화학적으로 반응 또는 흡착을 통해 일종의 보호막을 형성하여 전지의 열화를 억제하거나 안전성을 향상시키는 등의 역할을 한다. 둘째는 전해액 자체의 특성을 향상시키는 첨가제로서 용매나 리튬염에 직접 작용하여 안정성이나 이온 전도도를 높이거나, 혹은 전해액의 안정성을 저해하는 불순물 (수분, HF, 기타 부산물)을 제거하는 역할을 한다.
기능성 전해액 첨가제의 대표적인 사례는 vinylene carbonate (이하 VC)이다. VC는 음극에서 전기화학적으로 환원되면서 SEI (solid electrolyte interface)층을 형성하는데 VC가 형성하는 SEI 층은 음극의 열화를 억제하는데 탁월한 효과를 보인다 [1-4]. 최근들어 VC가 음극뿐만 아니라 양극에서도 일종의 보호막을 형성하고, 전해액의 산화부반응을 억제한다는 논문이 보고되고 있다 [4]. VC에 대한 특허권은 일본 미쯔비시 화학이 소유하고 있으며, 미쯔비시 화학은 VC 특허를 바탕으로 지난 십수년간 LIB용 전해액 시장에서 메이저 플레이어로서의 지위를 누릴 수 있었다. 우수한 첨가제 개발의 위력과 중요성을 여실히 나타내는 사례라 할 수 있겠다.
3. LIB용 전해액의 요구특성
LIB의 주요 특성 (에너지/출력특성, 수명, 안전성 등)은 일차적으로 양극재와 음극재에 의해 결정된다. 그러나 그러한 특성들의 구현을 위해서는 적절한 전해액의 역할이 필수적이며, 최적의 전해액 조성 선택을 통해 의도하는 특성을 극대화할 수도 있다. 표 4는 LIB용 전해액에 요구되는 특성을 나타낸다. 이들 특성 중에서 이온 전도도와 전기화학적 안정성에 관하여 아래에 상술하기로 하겠다.
3.1 이온 전도도
일반적으로 유기용매의 이온 전도도는 수용액의 그것에 비해 현저히 낮고, 유기용매에서의 낮은 이온 전도는 유기용매를 사용하는 LIB의 충방전 속도를 제한하는 주원인 중 하나이다. 바꾸어 말하면 전해액의 이온 전도도를 높임으로써 LIB의 출력특성을 향상 시킬 수 있다. 또한, 활물질의 충진 양을 늘림으로써 전지의 체적 당 용량을 증가시킬 수도 있다. 이처럼, 높은 이온 전도도를 갖는 전해액의 개발은 매우 중요한 의미를 갖는다고 하겠다. 앞서 언급한 바와 같이 이온전도도는 전해액의 점도와 유전율에 크게 의존하는 데 각각은 이온의 mobility와 리튬염의 해리도(즉, 자유 이온의 수)를 결정하는 주요 인자이기 때문이다. 이온 전도도는 양이온의 전도도와 음이온의 전도도의 합으로 나누어 생각할 수 있다. 각 이온의 전도도의 전체 전도도에 대한 기여도를 transference number (t)라 한다. 일반적 LIB용 전해액에서 리튬이온의 기여도 (tLi+)는 용매와 리튬염의 종류에 의존하지만 대개 0.3 - 0.5 사이의 값을 나타낸다. 이처럼 실제로 중요한 것은 전해액의 이온 전도도(σel)가 아니라 리튬이온의 전도도(σLi+)라 할 수 있다.
tLi+ = σLi+ / (σLi+ + σanion) = σLi+ / σel
3.2 전기화학적 안정성
양극과 음극이 4 V 이상의 큰 전위 차이를 보이는 LIB는 높은 전기화학적 안정성, 즉 넓은 전기화학 창 (electro-chemical window)을 갖는 전해액을 요구한다. 전해액의 양극/음극에서 각각 전기화학적으로 산화/환원되는 반응은 LIB의 용량 손실 및 수명 열화 로 직결되므로 이러한 부반응을 효과적으로 제어하는 것은 매우 중요하다.
3.2.1 음극 계면에서의 환원반응
대부분의 상용 LIB의 경우, 양극의 작동 전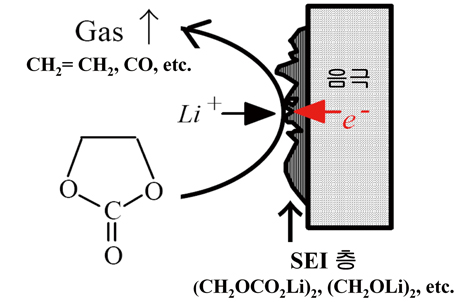 위의 범위는 Li 금속 대비 3 - 4.5 V, 음극의 그것은 0 - 3 V 정도이다. 따라서 전해액의 전기화학창은 0 - 4.5 V 이상으로 넓어야한다. Carbonate계 전해액의 산화전압은 4.5 V 이상으로 양극에서의 산화는 큰 문제가 되지 않은 반면, 환원전압은 0 V 보다 훨씬 높아 열역학적인 관점에서는 적당한 화합물이 아니다. 그럼에도 불구하고 carbonate계 전해액이 사용될 수 있는 이유는 carbonate계 전해액이 음극에서 환원 시 음극표면에 SEI 층을 형성하고 이것이 더 이상의 환원반응을 막는 동력학적 보호막 (kinetic barrier)의 역할을 하기 때문이다.
위의 범위는 Li 금속 대비 3 - 4.5 V, 음극의 그것은 0 - 3 V 정도이다. 따라서 전해액의 전기화학창은 0 - 4.5 V 이상으로 넓어야한다. Carbonate계 전해액의 산화전압은 4.5 V 이상으로 양극에서의 산화는 큰 문제가 되지 않은 반면, 환원전압은 0 V 보다 훨씬 높아 열역학적인 관점에서는 적당한 화합물이 아니다. 그럼에도 불구하고 carbonate계 전해액이 사용될 수 있는 이유는 carbonate계 전해액이 음극에서 환원 시 음극표면에 SEI 층을 형성하고 이것이 더 이상의 환원반응을 막는 동력학적 보호막 (kinetic barrier)의 역할을 하기 때문이다.
이상적인 SEI 층은 전기적으로는 높은 저항과 리튬 이온에 대한 높은 전도도를 보이는 것이다. 또한 SEI 층의 충방전 cycle에 따른 파괴가 적고 열적 안정성이 우수할수록 전지의 성능 열화는 효과적으로 방지 된다. 이와 같은 SEI 층의 특성은 SEI 층의 구성 성분에 따라 달라지고 이는 다시 사용되는 전해액과 음극의 종류에 의해 결정된다. 일례로서 표 5는 흑연 음극에서 효과적인 SEI 층 형성 여부가 용매의 종류에 의해 결정됨을 나타낸다.
그림 3은 ethylene carbonate (EC)에 의한 SEI 층 형성을 모식화 하였다. SEI 층의 두께는 대개 수 nm에서 수십 nm 이하로 매우 얇기 때문에 SEI 층의 조성 분석은 많은 어려움이 따른다. 간접적인 방법으로서 EC의 환원 분해 시 ethylene 이나 carbon monoxide와 같은 gas가 검출되며 이로부터 SEI 층의 조성을 아래와 유추해 볼 수 있다.
EC +2e- +2Li+ → (CH2OCO2Li)2 + CH2=CH2
EC +e- +Li+ → (CH2OLi)2 + CO
SEI 층의 열적 안정성은 ARC (accelerating rate calorimetry)나 DSC (differential scanning calorimetry)와 같은 열분석 방법을 이용하여 많은 연구가 이루어져있다. 표 6는 DSC로 측전한 리튬염에 따른 음극 SEI의 분해 개시 온도를 비교하였다. LiSO3CF3 나 LiN(SO2CF3)2 에 비해 LiBF4나 LiPF6를 사용하는 전해액에서 형성된 음극 SEI 층은 상대적으로 낮은 열적 안정성을 보이고, 이러한 낮은 열적 안정성으로 인해, 새로운 음극표면의 노출이 이루어지게 된다. 즉, 추가적인 음극과 전해액의 부반응을 유발하게 된다 [6].
3.2.2 양극 계면에서의 산화반응
상용 LIB용 카보네이트계 전해액의 산화 전압은 대부분의 양극물질의 작동 전위보다 훨신 높다. 따라서 전지가 고온에 노출되거나 과충전이 되는 등의 극한 조건이 아닌 정상적인 충방전 조건에서 전해액의 산화 반응은 거의 발생하지 않는 것으로 생각되어져 왔다. 그러나 최근의 연구 결과들은 양극 표면에서도 전해액의 분해 부산물이 존재한다는 사실을 입증하고 있다 (그림 3). 이 전해액 분해 부산물은 전해액의 화학적 반응에도 기인하지만 많은 부분은 전기화학적 산화반응에 의한 것이다. 이처럼 정상 충방전 시에도 양극에서 전해액의 산화가 일어나는 이유는 양극의 국부적인 전압 상승이나 온도 상승에 기인하는 것으로 추정된다. 특히, 충방전 횟수가 증가함에 따라 음극보다는 양극의 임피던스가 크게 증가하여 수명을 저하시키는데, 그 임피던스 증가의 주원인이 전해액의 산화 반응으로 인해 생성되는 부산물이 양극표면에 누적되기 때문으로 알려져 있다. 이처럼 양극의 bulk 특성보다는 표면의 변화가 전지 성능 열화의 주요한 원인으로 밝혀지면서 양극의 표면 개질을 통해 표면 반응성을 제어하고자하는 많은 시도들이 진행되고 있다. 전해액 측면에서는 양극과의 화학적 혹은 전기화학적 반응성이 낮은 전해액의 개발이 중요하겠다. 하지만 어느 정도의 양극과의 반응성은 안전성 측면에서 바람직하다는 점을 인식하여야 한다. 양극 표면의 부산물은 많을 경우 성능 저하의 원인이 되지만 적당량 존재시에는 양극의 안전성에 도움을 주는 것으로 알려져 있다 [8].
4. 향후 연구개발 동향
4.1. 신규 리튬염
-----------이하 생략, 자세한 내용은 세라믹코리아 5월호를 참조바랍니다. ----------
이 호 춘
- 1994 한국과학기술원(이학사 - 화학)
- 1996 한국과학기술원(이학석사 - 전기화학)
- 2000 한국과학기술원(이학박사 - 전기화학)
- 2000. 4~2001. 9 미국 Brookhaven Nat’l Lab. (Post-Doc.)
- 2001. 9~2008. 8 LG화학 기술연구원 배터리연구소
- 2008. 9~2011.2 금오공과대학교 응용화학과 조교수
- 2011. 3~현재 DGIST 에너지시스템공학 조교수
표 1. LIB용 Electrolyte의 용매 종류에 따른 분류 및 각각의 특성
표 2. LIB용 전해액의 주요 용매들의 물리적 특성
표 3. 주요 리튬염의 특성 비교
표 4. LIB용 전해액의 요구 특성
표 5. 용매에 따른 흑연 음극에서의 효과적 SEI 층 형성 여부
표 6. 리튬염에 따른 음극 SEI 층의 열적 안정성 비교 [6]
그림 1. LIB의 충방전 시 전자 및 리튬 이온 이동 모식도
그림 2. LIB용 전해액의 구성성분
그림 3. Ethylene carbonate (EC)의 전기화학적 환원 반응에 의한 음극 표면에서의 SEI 층 형성 [5]
그림 4. XPS 분석 결과로부터 추정되는 양극 표면층의 단면 모식도 [7]
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net