삶의 질 향상을 위한 바이오세라믹 소재
윤 희 숙_ 재료연구소 분말/세라믹연구본부 책임연구원
이 종 만_ 재료연구소 분말/세라믹연구본부 책임연구원
송 인 혁_ 재료연구소 분말/세라믹연구본부 책임연구원
1. 서론
우리나라는 고령화 사회의 진입은 선진국에 비해 늦었지만 심각한 저 출산율의 진전과 급격한 경제성장, 생활환경 개선 및 의료기술의 발전에 의한 평균수명의 증대로 세계에서 가장 빠른 속도로 고령 사회 진입을 목전에 두고 있다. 즉, 고령화는 전체인구에서 65세 이상 인구가 차지하는 비율로, 7% 이상을 고령화 사회, 14% 이상을 고령 사회, 20% 이상을 초고령 사회라고 구분하며, 우리나라의 경우 약 5년 후인 2018년이면 고령사회에 도달함이 예측되고 있다 (표 1). 사람이 오래 사는 것은 축복일 수 있지만 증가된 수명이 그 의미를 발휘하는 것은 살아있는 동안 건강하게 생산활동을 하며 삶의 질 (Quality of Life, QOL)을 유지할 수 있는 것이 전제조건이 될 것이다. 하지만 불행히도 나이의 증가와 함께 여러 가지 질병에 쉽게 노출된다. 노화현상은 65세가 되어 갑자기 일어나는 것이 아니며 서서히 진행된다. 즉, 일반적으로 치주염은 30대, 노안은 40대에 시작이 되며 신체의 운동능력과 직접적 관련이 있는 근골격계의 골질과 골량은 20세에서 40세를 피크로 차츰 저하된다. 이로 인하여 가령과 함께 골다공증으로 대표되는 각종 골질환에 의한 골절 등으로 운동능력이 급격히 떨어지고 삶의 질을 보장받지 못하게 된다. 이러한 노화에 의한 신체기능의 저하는 개인의 삶의 질뿐만이 아니라 국가나 사회적으로도 크게 부담이 될 수 있다. 즉, 생산보다 소비가 많은 노인인구의 증가로 저축과 투자가 줄어들고 노동력이 부족하게 되어 국가경제가 활력을 잃게 된다. 따라서 고령자의 사회복귀 및 활기찬 고령사회 실현으로 개인의 삶의 질을 높이고 국가의 경제적 부담을 경감시키기 위하여 노화와 함께 퇴화 혹은 손상되는 신체기능을 복원 혹은 향상시킬 수 있는 바이오기술개발에 대한 요구가 날로 강해지고 있다. 바이오소재는 이러한 바이오기술에 있어 중요한 역할을 하는 요소이다. 고분자, 금속, 그리고 세라믹 소재는 간혹 서로 상충되는 분야도 있으나 각 소재의 특성 때문에 각각 서로 다른 분야에 활용되고 있다. 이 중 세라믹소재는 인체의 운동기능과 직접 관련된 경조직 질병관련 치료 즉, 정형외과 및 치과치료용 소재로 주로 활용된다. 인체 골의 경우 약 70%가 인산칼슘계의 세라믹 성분으로 구성되어 있기 때문이다. 본고에서는 이와 관련하여 바이오세라믹 소재의 간략한 소개와 더불어 그 연구동향 및 활용분야를 소개하고자 한다.
표1. 고령화 속도 국제비교 (일본국립사회보장·인구문제연구소, 인구통계자료집, 2010년)
도달년도 증가소요년수
7%
(고령화) 14%
(고령) 20%
(초고령) 7% → 14% 14% → 20%
프랑스 1864 1979 2018 115 39
영국 1929 1975 2028 46 53
미국 1942 2014 2032 72 18
일본 1970 1994 2005 24 11
한국 2000 2018 2026 18 8
2. 본론
2.1. 바이오세라믹스의 정의 및 분류
바이오세라믹스란 인체 내에 이식되어 단기간 또는 장기간 동안 손상된 인체의 조직이나 기관의 기능을 치료·대치·회복시키는데 사용되는 세라믹소재로, 골조직과 화학적으로 유사하거나 우수한 기계적 특성 및 생체친화성으로 인하여 경조직 재건이나 재생에 주로 이용된다.
바이오세라믹스는 이식된 소재의 인체 내 생물학적 반응성에 따라 생체불활성 (bioinert)과 생체활성 (bioactive)으로 나뉘며, 생체활성 세라믹은 또 다시 흡수성 (resorbable)과 비흡수성 (non-resorbable)으로 분류된다. 화학적 조성에 따라 알루미나, 지르코니아, 티타니아, 인산칼슘계 등의 산화물계, 실리카를 포함하는 유리계, 그리고 카본계로도 분류할 수 있다. 또한 그 형상에 따라서 분말, 섬유, 코팅, 벌크계 혹은 다공체와 치밀체로 구분하기도 한다.
2.2. 바이오세라믹의 기술개발 진화
1950년대에 시작된 1세대 바이오세라믹 연구개발의 주요 목적은 생체와 아무런 반응을 하지 않는 것이 생체에 가장 안전한 바이오소재라 인식하여 이식된 부위에서 어떠한 생물학적 반응도 하지 않는 생체불활성 바이오세라믹 소재를 개발하는 것이었다. 하지만 지르코니아와 알루미나로 대표되는 생체불활성 세라믹은 체내 이물질 반응에 의하여 무세포성 교원질로 둘러싸여 이식부위로부터 고립되는 문제점이 발견되었다.
1980년대에는 근본적으로 소재개발 개념을 바꾸어 새로운 골을 형성시키기 위해서 체내 이식 시 주변 환경과 반응하는 생체활성 바이오세라믹 소재개발을 목표로 하였고 그 결과, 아파타이트 및 삼인산칼슘 등의 인산칼슘계 및 생체활성유리와 같은 유리계 바이오세라믹에 관한 연구가 활발히 진행되었다.
현재는 단순히 생체불활성 및 활성과 같은 물성제어가 아닌 이식될 부위의 원래 골조직 구조와 조성을 그대로 모방하여서 골조직 재생을 유도할 수 있는 소재, 즉 지지체용 다공성 바이오세라믹 소재개발 관련 연구가 활발히 진행되고 있다. 생체골을 모방하여 골재생을 유도하기 위해서는 생체골와 유사한 조성으로 구성되어짐과 동시에 수 나노미터에서 수 밀리미터 크기 영역에서 기공이 계층적으로 상호 연결되어진 다공성 구조로 구성된 바이오세라믹 소재가 개발되어야 한다. 생체골은 수 나노미터 크기의 무기질 아파타이트 입자와 수 십마이크로미터의 유기질 콜라겐 섬유를 기본 단위로 한 계층적 구조체로 이루어져 있으며, 각 크기 영역에서 각각 서로 다른 중요한 기능을 하기 때문이다 (그림 1). 즉, 1 마이크로미터 이하의 기공은 생체활성과 단백질의 상호작용에 관여하고, 1-20 마이크로미터 기공영역은 세포반응과 부착되는 세포종류를 결정하며, 100-1000 마이크로미터 크기 영역은 세포성장, 혈액유동 및 기계적 물성과 관계가 있고, 1000 마이크로 이상의 크기는 이식체의 형상과 기능에 관여한다. 한편, 나노미터 크기영역은 약물 및 성장인자 등의 생체활성물질 전달을 통해 보다 효율적 골재생을 유도하고 치료효과를 촉진시키는 기능성 부여를 위해 필요하다.
향후는 현재까지 진행되고 있는 바이오세라믹스 소재 물성 및 구조 제어와 더불어서 이식된 소재가 이식부위별 생체조직 재생 속도 및 생성 메커니즘에 맞추어 흡수되어 효율적으로 생체골 재생을 유도할 수 있도록 생분해성과 흡수성이 면밀히 제어된 소재개발이 필요하다. 또한, 최소한의 노력으로 최대한의 효과를 얻기 위하여 소재가 체내에 이식되어 있는 동안 염증발생 등으로 인하여 이식물 주변의 환경 변화 시 소재 스스로가 판단하여 진단 및 치료를 하여 재수술의 위험성을 줄일 수 있는 지능형 소재 설계 및 개발이 기대된다.
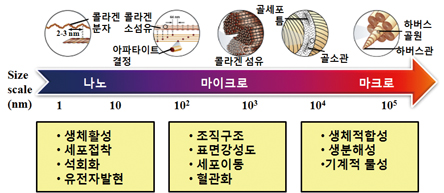
그림 1. 생체골의 구조와 기능 1)
2.3. 바이오세라믹스의 응용
<인공골>
외상 혹은 골종양 절제 등으로 광범위한 골결손이 생긴 경우 골결손을 메우기 위한 방법으로, 우선적으로 자가이식 (autograft)이 많이 시행되나 자가골 채취에는 건강한 부위의 골을 외과적으로 채취해야하는 추가적 수술의 부담과 채취할 수 있는 량에 한계가 있다는 문제점이 있다. 이에 자가골을 대신하는 인공골 충진재료 개발연구가 시행되어 왔다. 골충진재용 바이오세라믹스에는 골의 무기성분과 같아 생체친화성이 높은 아파타이트계 이외에 유사한 효능이 기대되는 인산칼슘계 및 생체유리계 등이 있다. 정형외과, 뇌신경외과 및 구강외과를 중심으로 적용되고 있으며 그 용도에 따라 여러 가지 형태로 전신에 걸쳐 적용된다 (그림 2). 또한 사용 용도에 따라 그 구조가 결정되며 상대밀도 99% 이상의 치밀체와 수백 마이크로미터의 기공을 포함하는 다공체가 있으며, 적용 부위와 목적에 다라 기공 분포 및 강도의 제어가 가능하다 (그림 3). 인공골의 사용목적은 ‘골결손부의 충진’에서 ‘생체골 기능의 재생’으로 변화하고 있으며 이를 위하여 보다 효율적으로 골재생을 유도하는 소재 및 구조 개발에 관한 연구가 진행되고 있으며, 최근에는 생체골 구조를 모사한 계층적 기공구조를 가지는 인공골 개발과 관련된 연구가 활발히 이루어지고 있다. 한편, 높은 강도를 가지나 생체골에 비해 탄성이 부족하여 발생되는 문제를 해결하고 보다 골과 유사한 조성을 제공하기 위하여 유무기 복합체로써의 재료개발 연구도 활발히 진행되고 있다.

그림 2. 인공골의 사용 예 2)
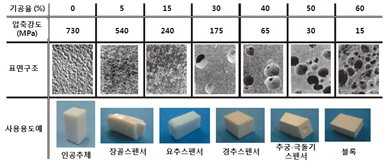
그림 3. 인공골의 기공률과 강도, 기공구조 비교 2)
<인공관절>
골·관절 등이 사고나 질환에 의하여 통증이 심해지거나 그 기능을 잃게 된 경우, 인공물질로 대체하는 치료법은 현재 일반화 되어있다 (그림 4). 인공관절수술은 통증의 제거 및 다시 본인의 다리로 걸을 수 있게 되는 등 삶의 질 향상과 직결되어 있다. 하지만 인공재료이므로 신체 내부에서 견딜 수 있는 기간이 한정되어 있고 골 등의 생체조직과 결합하는 부분이 파손되는 등의 문제점도 여전히 남아 있어 보다 오랫동안 안전하게 사용 가능한 소재개발이 필요하다. 일반적으로 인공고관절의 경우 폴리에틸렌 수지제의 골반측 컵과 그것에 맞혀지는 인공골두, 그리고 골두를 대퇴골에 고정하기 위한 금속제의 지지봉 등의 부품군으로 구성되어 있다. 골두 부분은 과거에는 금속중심으로 사용되어졌으나 현재는 알루미나 및 지르코니아와 같은 불활성 바이오세라믹 소재의 사용이 제안되어지고 있다 (표 2).
알루미나는 고순도화된 평균결정크기 1-2 마이크로미터 정도의 미세결정구조를 가지는 것으로 고강도 특성을 나타낸다. 또한 고경도, 치밀한 구면·표면가공에 의하여 저마찰특성이 실현되고 있다. 한편, 지르코니아의 경우 역학적 특성이 뛰어나 골두, 구개의 외경을 작게하여 골 절삭량을 감소시키는 것이 가능하다. 소켓부분에는 폴리에틸렌이 사용되었으나 장기간 사용하면 마모분이 생기고 헐거워지는 부작용이 보고되고 있다. 이러한 문제를 해결하기 위하여 세라믹-세라믹 관절 사용이 제안되어지고 있으며 알루미나/지르코니아 복합체 관련한 연구도 주목받고 있다.
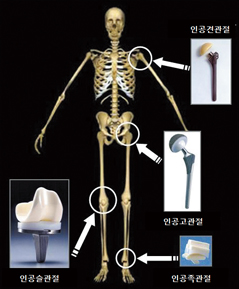
그림 4. 주요한 인공관절 3)
표 2. 인공관절에 사용되는 바이오세라믹 물성 3)
재료 알루미나 지르코니아
순도 Al2O3 > 99.5% ZrO2+HfO2+Y2O3 > 99%
밀도 3.97 6.08
영률 (GPa) 400 210
경도 (Hv) 1900 1300
굽힘강도 (MPa) 640 1600
<골시멘트>
일반적인 인공골 및 인공관절 등으로 사용되는 세라믹 소재는 소결형 소재이다. 이 경우 복잡한 형상의 골결손부나 골절부 등을 충진하기에는 미리 CT사진 등으로 삽입물을 설계제작하고 수술 중에 조절 등의 조작이 필요하다. 의사들은 복잡한 형상의 환부에도 유연하게 대응할 수 있는 소재를 원하며, 골시멘트는 점토상 혹은 패이스트상이기 때문에 이러한 요구사항을 충족시킬 수 있다. 골시멘트에는 단량체의 중합반응을 통해 경화되는 아크릴계 시멘트와 화학적 조성에 따라 산-염기 혹은 가수분해와 같은 화학반응을 통해 경화되는 인산칼슘계 시멘트가 있다. 전자는 접착의 기능에 충실하므로 인공관절 등 금속 임플란트의 고정에 흔히 사용되나 시멘트 반응시 일어나는 급격한 발열반응으로 인해 주변 조직이 괴사되는 등의 부작용이 지적되고 있다.
한편, 후자는 초기에는 경화를 위해 80°C 이상으로 수 시간 가열하는 공정을 거쳤으나, 경화액에 유기산을 사용하는 것으로 경화에 필요한 온도 및 시간을 크게 저감시켰으며, 아크릴계 보다 조직친화성이 높아 접착특성보다는 경화특성 및 생체친화성을 활용하는 측면이 강하다.
인산칼슘계 시멘트는 최종생성물을 기준으로 아파타이트 및 브루사이트계로 구분된다 (그림 5). 골시멘트에 있어서 중요한 특성은 경화시간, 주사성, 점착성 및 강도 (압축강도)이다. 경화시간은 수술 시 의사의 조작 및 그 후 수술의 흐름에도 크게 영향을 미친다. 분말과 용액의 혼합개시로부터 경화시간은 제품에 따라 다르나, 정상체온 (37°C)에서 3-15분 정도이다. 주로 Gillmore 바늘 테스트로 평가되는 초기 경화시간이 특히 중요한 역할을 하며, 일반적으로 치과용으로는 3분, 정형외과용으로는 8분에 가까운 것이 바람직하고, 말기 경화시간이 15분을 넘지말아야 한다고 알려져 있다.6)
골시멘트의 경우 의사가 환부에 적용한 패이스트를 직접 손으로 형태를 다듬어 마무리 하는 경우와 주사기를 통해 손이 닿지 않는 치료 부위로 적용하는 경우가 있으며 후자의 경우 패이스트가 좁은 주사기의 구멍을 통해 흘러나가야 하므로 우수한 주사성이 필요하다. 점착성 (cohesion)은 시멘트가 시술부위에 적용된 후 그 형상을 안정성있게 유지하면서 경화에 도달할 수 있는 능력을 일컫으며, 패이스트가 경화되기 전에 혈액 등 체액에 흐르는 조건에 노출된 결과 형상을 유지하지 못하고 일부가 유실되어 원래 의도한 기능을 실패하고 염증을 발생시키는 등의 문제를 일으킬 수 있으므로 점착성 역시 매우 중요하게 다루어지는 특성이다. 기계적 물성에 있어서 골시멘트는 해면골 처럼 자연골의 가장 약한 부분보다 강해야 충전재로서의 의미가 있으므로 10MPa 이상의 압축강도가 요구된다. 하지만 신체 이식후 압축은 물론 인장, 전단, 비틀림 등의 상태에서 응력을 받고 인산칼슘계 골시멘트도 일반 세라믹과 유사한 취성파괴특성을 나타내므로 실제로는 10MPa보다 훨씬 큰 압축강도를 가져야만 한다. 아파타이트계 시멘트는 인장에서 16MP, 압축에서 83MPa인 반면, 브루사이트계 시멘트는 각각 10MPa 및 60MPa로 다소 약하며 생분해성을 나타낸다. 이러한 골 시멘트는 두개골 및 구강악안면 성형, 골절치료, 경피적 척추 성형술 등에 적용된다.
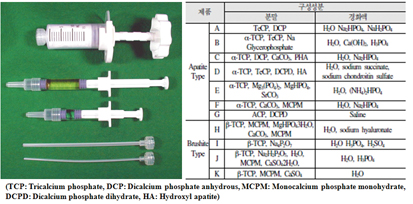
그림 5. 골시멘트 제품 예 및 인산칼슘계 시멘트 구성성분 예 4, 5)
<인공치아>
치아는 인간에 있어서 식사, 발음, 용모 등 매우 중요한 역할을 한다. 충치나 질환, 사고 등으로 치아를 잃게 된 경우 인공치아를 이용한 기능과 형상을 대체할 물질이 필요하며 이것이 인공치아이다. 인공치아로는 세라믹소재, 레진 (플라스틱)소재 및 금속소재가 제조되고 있다. 이중 세라믹소재는 레진소재에 비해 내마모성, 내변착색성, 및 음식물의 분쇄능력유지 특성 등 기능성, 심미성 및 생체친화성이 우수하여 세계적으로 널리 사용되어지고 있다. 원료성분은 도자기와 같이 장석, 규석 및 점토 등이 사용되며, 금속산화물로 이루어진 착색재를 배합하여 제조된다. 한편, 인공치근은 1952년 발명초기에는 순수 금속티탄제품이 사용되었으나 골과의 친화성을 높이기 위하여 세라믹제의 인공치근 혹은 티탄 위에 생체친화성이 높은 아파타이트 세라믹 등을 코팅하는 여러 가지 방법 등이 제안되고 있다.
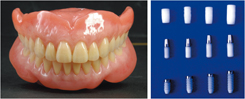
그림 6. 인공치아 (좌)와 인공치근 (우) 7)
2.4. 나노-바이오세라믹스
나노기술이 발전하면서 나노측정기술과 나노가공기술이 함께 발전하게 되었고, 이는 나노미터 크기 영역에서 골구조 및 기능의 관찰과 연구를 가능하게 되었다. 그 결과 많은 과학자들은 나노복합체로 구성된 생체골의 조성과 표면특성이 세포의 존속·증식·성장 및 분화에 영향을 줄 뿐만 아니라 유전자 발현과 유전 표현형 보존에도 영향을 주는 등 조직재생에 큰 긍정적 효과가 있음을 밝혀내었다. 이에 나노-바이오 융합기술의 중요성이 대두되고 있다.
< 생체 친화력 >
서두에 설명하였듯이 생체골은 나노결정질 아파타이트와 선형분자 사슬로 이루어진 콜라겐으로 구성된 유무기 나노복합체이다. 또한 세포외기질의 다른 단백질 성분들도 나노미터 크기이며, 자기조립된 나노구조 세포외기질은 중간엽 줄기세포, 조골세포, 용골세포에 둘러싸여 섬유아세포의 접착·증식·분화에 밀접한 영향을 미친다. 나노상 복합소재는 실제 뼈와 비슷한 굽힘·인장강도를 갖도록 합성할 수 있으며, 무기질 소재의 크기를 나노입자로 축소하므로써 기계적 물성의 개선과 더불어 표면에 아파타이트를 형성시켜 염증 및 면역반응 없이 안전하게 뼈와 화학적 결합을 가능하게 하는 생체활성이 증가되는 효과도 보고되고 있다.
< 표면특성 >
나노크기의 생체소재는 경조직과 크기 및 구조면에서 유사성 뿐만 아니라 표면적·표면형성·표면화학·표면 젖음성 및 표면에너지 등 특유의 물리화학적 표면특성을 나타낸다. 이러한 나노소재의 표면특성은 단백직의 흡착과 생물학적 활성도, 세포 거동과 조직재생 특성에 큰 영향을 미친다. 즉 나노소재는 높은 표면적을 가지며 이로 인해 표면 젖음성이 증가하는 동시에 많은 양의 특정 단백질과의 상호작용을 활성화시켜 새로운 뼈의 성장을 촉진시키는 효과가 있으며 골전도도를 향상시키는 효과도 보고되고 있다 (그림 7).
< 기능성 물질전달 >
-------------이하 생략 (자세한 내용은 세라믹코리아 2013년 2월호 참조요망)
참고문헌
1. V.E. Santo, M.E. Gomes, J.F. Mano, R.L. Reis, Nano-medicine, 7, 1045, 2012
2. T. Nakajima, Ceramics, 43, 984, 2008
3. K. Ueno, Ceramics, 43, 994, 2008
4. 오경식, 세라미스트, 12, 54, 2009
5. M. Abe, Ceramics, 43, 989, 2008
6. S.V. Dorozhkin, Materials, 2, 221, 2009
7. R. Yoshimoto, Ceramics, 44, 547, 2009
8. L. Zhang, T.J. Webster, Nano Today, 4, 66, 2009
9. 윤희숙, 송인혁, Ceramic Korea, 24, 60, 2011
10. T.J. Yoon, K.N. Yu, E. Lim, J.S. Kim, B.G. Kim. S.H. Yun, B.H. Sohn, M.H. Cho, J.K. Lee, S.B. Park, Small, 2, 209, 2006
11. 소재기술백서, 재료연구소, 2010
12. M. Vallet-Regí, E. Ruiz-Hernández, Advanced Ma-terials, 23, 5177, 2011
윤 희 숙
- 2004 University of Tokyo 재료학전공 박사
- 2004 National Institute of Advanced Industrial Science and
Technology (AIST), Japan 박사후 연구원
- 2005 Waseda University 강사
- 2006~현재 재료연구소 엔지니어링세라믹연구실 책임연구원
- 2011~현재 UST 신소재공학과 겸임교수
이 종 만
- 2010 광주과학기술원 신소재공학과 박사
- 2012 Wake Forest Institute for Regenerative Medicine,
박사 후 연구원
- 2012~현재 재료연구소 엔지니어링세라믹연구실 선임연구원
송 인 혁
- 2003 KAIST 재료공학과 박사
- 2005-2007 창원대학교 세라믹공학과 겸임교수
- 1992~현재 재료연구소 엔지니어링세라믹연구실장, 책임연구원
- 2009~현재 UST 신소재공학과 겸임교수
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net