이온 전도성 산소 분리막 개발 동향
우 상 국_ 한국에너지기술연구원 에너지 융합소재연구단 책임연구원
1. 서 론
가. 개발 기술의 필요성
현재의 에너지시스템은 대량생산 및 소비를 위하여 화석에너지를 과도하게 사용하여 온실가스를 너무 많이 발생시키고 있어 기후변화에 영향을 주고 있다. 이로 인해 지난 100년 동안 전 세계적으로 기온이 약 0.74℃가 상승하였으며 특히 우리나라의 경우에는 급격한 현대화에 따라 전 세계의 기온 상승의 2배 이상인 약 1.7℃가 상승하였다.(1) 또한 미국 National Wildlife Federation에서 발간된 보고서에서 알 수 있듯이 기후 변화에 따라 자연 재해가 잇따르고 있는데 이러한 기후 변화의 주범으로 이산화탄소가 지목되고 있으며 화석연료의 사용 시 필수적으로 배출되는 이산화탄소의 회수 및 처리 등은 매우 중요 한 것으로 알려져 있다.
이산화탄소의 배출원인으로 가장 높은 비율을 차지하는 화력발전 분야에서 이산화탄소를 농축, 포집하려는 CCS(carbon capture and sequestration)기술은 이러한 이산화탄소 감축을 위한 가장 대표적인 기술이다.(2) CCS 기술은 [그림 1]과 같이 세가지 방식으로 구분된다.
즉, 연소 후 배기가스에 포함된 이산화탄소를 포집하는 기술인 연소 후 포집기술, 천연가스나 석탄과 같은 연료를 수소와 이산화탄소로 변환하여 이산화탄소만 별도록 분리하고, 발생된 수소를 가스터빈으로 연소하는 연소전 포집기술. 공기가 아닌 순수한 산소를 산화제로 사용하여 연소하는 순산소 연소기술이다. 차세대 발전설비로 집적가스화설비(IGCC) 기술이 개발되어 설치되고 있으며 이러한 IGCC 공정에서 석탄을 가스화 하기 위해 필요한 핵심적인 기술은 순산소 제조기술이다.
이산화탄소로부터 산소를 분리하는 방법에는 심냉법, 흡착법, 막분리법 등이 있다. 현재 대규모 분리에 사용되는 상용화된 산소제조기술은 심냉법(cryogenic distillation)이다. 심냉법의 경우 고순도(95-99.99%)의 산소를 얻을 수 있지만 50 ton/day 이상의 대용량에 적합한 공정으로 초기 투자비가 크다. 흡착법을 이용한 PSA의 경우 중소규모로 가능성이 있지만 역시 제조 단가가 높은 단점이 있다. PSA 및 VSA 법을 이용할 경우 산소와 아르곤 사이의 유사한 흡착능으로 인한 아르곤 분리의 어려움으로 인하여 산소 최대순도가 95%에 머무르고 있으며 실제 산업현장에서 사용되는 경우 약 90-92%의 산소 순도와 함께 3-5%의 질소 불순물도 포함하게 된다. 이러한 질소 분순물은 순산소 연소(oxy-fuel combustion)공정에서 NOx를 발생시켜 별도의 처리시설이 필요하게 만드는 문제를 일으킨다. 따라서 선진국을 중심으로 낮은 제조 비용으로 고농도의 산소를 얻기 위한 세라믹 분리막에 대한 연구가 활발히 진행되고 있다. 세라믹 분리막을 이용한 산소 분리기술은 수천 TPD급 IGCC 발전설비용 공기분리장치(Air Separation Unit, ASU)에 적용할 수 있으며 경제적으로도 기존의 심냉법 대비 30-50%까지 설비비용을 절감할 수 있어 산소제조에 필요한 전력소모를 1/3 정도 낮출 수 있다. 1985년 Teraoka 등에 의하여 제시된 이온전도성 세라믹 분리막(Ion Transport Membrane, ITM)을 이용하여 고순도의 산소를 선택적으로 분리할 경우 매우 효과적으로 이산화탄소에서 산소를 분리할 수 있기 때문에 미래 청정 사회로 나아가기 위해서 이온전도성 세라믹 분리막의 개발이 절실히 필요하다.
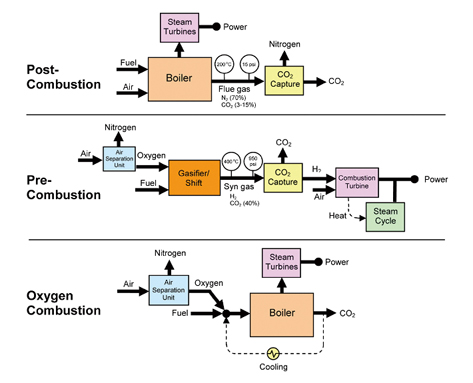
[그림 1] CO2 분리 포집 기술 분류 개략도 (미국 DOE/NETL)
나. 개요
높은 이온전도성을 이용하여 산소함유 기체혼합물로부터 순수한 산소를 선택적으로 분리해내는 산소투과용 분리막으로 사용될 수 있는 4가지 구조적 형태를 [그림 2]에 도식적으로 표현하였다. 첫째는 전도성을 갖는 전극을 필요로 하는 고체산화물 전해질의 경우([그림 2](a))로서, 전기에 의해 구동되는 산소펌프(oxygen pump)로 이용될 수 있다. 전기적으로 구동될 경우의 장점으로는 압력구배를 가하기 위한 별도의 압축기 등이 필요 없다는 점이다. 다만, 외부적으로 전자의 흐름 경로를 제공하기 위한 회로가 필요하다는 점이 단점이 된다.
두번째 경우는 독립적인 두개의 상으로 구성된 분리막으로서, 산소이온 전도성 산화물 기지상에 금속상이 분산되어 있는 형태이다([그림 2](b)). 실험결과적으로는, 이러한 재료를 통한 산소의 투과도가 작은 편이어서 산소분리막으로 실제 적용하기에는 무리가 있다. 세번째 경우는 혼합 이온-전자 전도체를 이용하는 경우이다([그림 2](c)). 구동력인 산소분압의 구배가 분리막의 양단에 가해지기만 한다면 기체투과는 지속적으로 발생하게 된다. 고체 전해질을 이용하는 경우에 비하여, 외부회로가 필요 없으므로 장치가 간단해지는 장점이 있다. 다공성 지지체를 이용한 비대칭 분리막의 경우([그림 2](d))에는, 분리막의 두께를 감소시킬 수 있으므로, 전체적인 산소투과 유속이 현저히 증진되어, 근래에 많이 연구되고 있다. 세번째 모델에 해당하는 혼합전도성 분리막에서의 산소투과유속은 분리막 내부에서의 확산유속 또는 분리막 표면과 기상과의 계면에서의 산소분자-이온 교환반응속도에 의해 결정되며, 각각의 과정이 전체 산소투과유속의 속도결정단계가 될 수 있다.
혼합 전도성을 갖는 세라믹 분리막은 [그림 3]와 같이 산소 이온이 이동하는 반대방향으로 전자가 이동하거나 산소 이온의 이동과 같은 방향으로 공극(vacancy)이 이동함으로써 외부의 인가전압 없이 산소분리가 가능하다. 공기 중의 산소가 압력에 의해 ITM 표면으로 이동하여 흡착된 후 산소 dissociation과 전자 전달에 의해 O2-이온으로 전환된다. 이후 O2-이온은 ITM의 산소 이온 vacancy를 통해 산소 압력이 낮은 쪽으로 이동하며 낮은 압력의 막표면에서 이동된 이온은 association이 되면서 전자를 내놓고 산소분자로 산소가 분리된다.
이러한 혼합 전도성 재료는 결함 모델에 따라 [표 1]과 같이 구분할 수 있다.(3) 첫째, 이동성 이온의 농도가 전자/정공의 농도에 비하여 매우 큰 경우(p, n << Ni)로서, 고체 전해질(solid electrolyte)소재가 이 범주에 속한다. 지르코니아와 같은 형석(fluorite) 구조를 가지면서, 높은 이온전도도를 나타내는 doped-CeO2도 이 분류에 포함되며, AgCl, CuBr, 그리고 PbBr2와 같은 할로겐 화합물도 이 범주에 속한다. 둘째로, 이동성 이온 결함이 전하중성(charge neutrality)을 유지하기 위해 quasi-자유전자 또는 정공으로 보상되는 경우이다(n=zNi or p=-zNi). 환원분위기하에서 화학양론에서 벗어나 산소빈자리가 생성되며, 전자는 의 donor 에너지 준위로부터 전도대로 열적으로 여기된다. 다른 양이온이 치환되지 않은 상태의 CeO2-x가 이 모델의 대표적인 경우이며 다성분계 페롭스카이트(ABO3)도 온도와 산소분압 조건에 따라 어느 정도의 차이는 있지만, 본 범주에 속한다고 볼 수 있다. 셋째 경우는 전자/정공의 농도가 상대적으로 커서(n or p >> Ni) 금속에 가까운 특성을 갖는 혼합전도체이다. n-type 또는 p-type 반도체에 비교적 적은 농도의 이동성 이온을 첨가하거나 화합물의 화학양론을 변화시킴으로써 얻을 수 있다.
[표 2]에는 이온전도성 산화물과 혼합전도성 산화물의 대표적인 산화물의 예를 정리하였다. YSZ, SDC, 및 LSGM과 같은 이온전도성 산화물은 SOFC의 전해질로 사용되며, 단상 또는 2상구조 혼합전도체는 기체분리를 위한 ITM 소재나 SOFC의 전극소재로 활용되고 있다.
이온전도성 세라믹 분리막의 재료로 가장 많이 사용되고 있는 페롭스카이트는 [그림 4]에 나타낸 것과 같이 ABO3을 기본단위 구조로 가지고 있다. 여기서 A-자리 양이온으로는 희토류, 알칼리금속, 알카리토금속 또는 Pb2+나 Bi3+와 같은 큰 반경의 이온이 위치하게 되며 페롭스카이트 구조 중 dodecahedral에 위치하게 된다. B-자리에는 3d, 4d, 5d의 orbital 구조를 가지고 있는 전이금속 이온들이 octahedral 위치에 자리잡게 된다. A-자리에는 정육면체에서 각 원자의 1/8씩 총 8개 위치를 차지하게 되며, B-자리에는 중심에 한 개의 원자, 산소이온은 정육면체의 면 중앙에 1/2개씩 총 6면을 차지하게 되어 ABO3를 이루게 된다. 일반적으로 페롭스카이트 구조는 A, B 위치를 차지하고 있는 원자의 반경과 산소의 반경 사이의 관계 인자인 tolerance factor, t 값이 0.8~1.0의 값을 갖는 경우에 안정한 구조를 갖는다.
많은 페롭스카이트 구조 산화물은 기본적인 ABO3 페롭스카이트 단위가 층을 이루며 쌓여진 형태이다. 따라서 ABO3의 기본 구조에서 적층의 방식에 따라 A2BO4, A3B2O7과 같은 다양한 형태로 변형이 될 수 있다. 또한 A, B의 각 위치에 서로 다른 이온 전하를 갖는 성분들이 일부 교체가 될 수 있는데, 이러한 현상에 의하여 산소 원자의 개수가 정확하게 AB의 전하중성(charge neutrality)을 유지하지 못할 경우에는 Sr2FeO4-x, Sr3Fe2O7-x, La0.6Sr0.4CoO3-x와 같은 산소결핍(oxygen deficient) 페롭스카이트 또는 YBa2Cu3O6+x와 같은 산소과잉(oxygen excess) 페롭스카이트가 생성되게 된다. 만약 산소결핍 페롭스카이트 구조가 적층되어 있는 경우, 반응성을 가진 산소 이온이 근접하게 된다면 결핍된 산소 구조에서 산소가 전자를 잃고 빈자리가 채워지게 되며 바로 접해 있는 기본 페롭스카이트 구조로 이동을 하게 된다. 이러한 이동 과정이 끝나면 마지막 페롭스카이트 구조에서 나온 산소 원자는 다른 구조에서 나오는 산소원자와 결합하여 다시 산소분자를 이루게 되며 이러한 과정의 반복을 통해 혼합가스중의 산소는 연속적으로 혼합전도성 산화물을 통해 이동하게 되어 순수한 산소로 분리될 수 있게 된다.
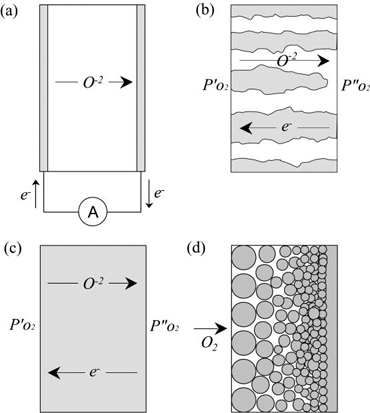
[그림 2] 산소이온 전도체를 이용한 분리막 개념도: (a) 고체전해질 (산소펌프), (b) dual phase 분리막, (c) 단체형 혼합전도성 분리막, (d) 후막형 분리막
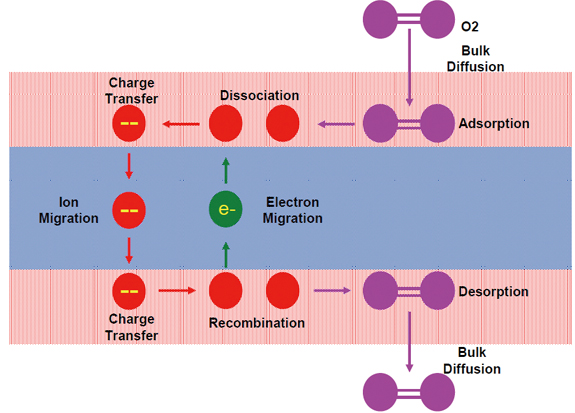
[그림 3] 혼합전도성 분리막의 산소 분리 메카니즘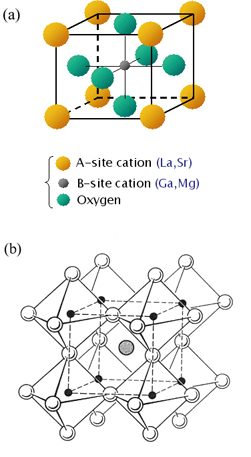
[그림 4] ABO3 페롭스카이트 산화물의 구조: (a) 단위격자; (b) 다면체 구조
[표 1] 전하 나르개 농도에 따른 혼합전도성 산화물의 분류
[표 2] 이온전도체와 혼합전도성 산화물의 대표적인 소재
2. 본 론
가. 연구개발 동향
산소 투과용 세라믹 멤브레인의 경우, 고온에서 운전되나 산소에 대한 선택도를 거의 무한대로 유지할 수 있기 때문에 10년 전부터 미국과 일본, 유럽의 선진국에서는 투과도를 향상시킬 수 있는 세라믹 조성과 고온, 고압의 조업 조건에서 견딜 수 있는 내구성 소재 개발 연구를 진행되어 왔다. 90년대 후반에는 개발된 페롭스카이트 계열(A1-xA’xB1-yB’yO3-z) 막소재를 이용하여 단위 공정 연구가 진행되었으며 2000년에 들어와서는 기존 산소 분리 공정과 연계하는 시스템 연구가 진행 중에 있다.
Teraoka 등이 La1-xAxCo1-yByO3-δ (A는 Sr, Ba, Ca 등, B는 Fe, Cu, Ni 등) 조성의 페롭스카이트 세라믹 분리막이, 안정화 ZrO2에 비해 동일한 온도에서 높은 이온전도도를 나타낸다는 결과를 보고한(4) 이후로, LaCoO3 조성을 기본으로 하고 여러 양이온을 치환한 페롭스카이트 구조의 이온전도체에 대하여 많은 연구가 진행되고 있다. 최근들어 여러 학자들에 의하여 이온전도성 분리막에 대한 총설을 발표한 바 있으며 그 중 Sunarso가 산소투과량과 온도와의 관계를 정리하여 [그림 5]와 같이 발표하였다.(5)
[그림 5]에서 알 수 있듯이 사용온도가 올라갈수록 산소투과도가 증가하는 것을 말 수 있지만 고온의 열적 기계적 열화와 시스템화를 위한 부속재료의 어려움 등이 존재하고 있어 현재의 연구는 연료전지와 같이 낮은 온도에서 산소투과도를 높이는 쪽으로 진행하고 있다. 미국의 the University of Houston‘s Texas Center for Superconductivity (TcSUH)에서 낮은 온도에서 작동하는 중저온 구동형 산소투과 분리막을 개발했다고 발표한 이래 이와 같은 double layered perovskite 구조를 이용한 저온용 양극재료가 연료전지를 중심으로 개발되고 있다.(6,7)
[그림 6]은 대표적인 산소분리막 소재의 투과도를 두께 1mm를 기준으로 분석하여 정리한 결과이다.(8) 현재까지 산소 투과도(permeablity)가 가장 높은 멤브레인 소재는 (Ba,Sr)(Co,Fe)O3 (BSCF) 물질이다. 그러나 BSCF는 CO2와 쉽게 반응하여 carbonate를 생성하며, 열팽창이 커서 실제 고온에서 사용할 때 열충격에 의해 쉽게 취성파괴가 일어나 실용화가 어렵다. 아직까지도 산소 투과율이 높고 기계적-화학적으로 안정한 멤브레인 소재에 대한 연구가 진행되고 있다.
<이하 생략-자세한 내용은 세라믹코리아 2013년 8월호를 참조 바람.>
우 상 국
- 1974.03 ~ 1978.02 연세대학교 공과대학 학사
- 1982.09 ~ 1987.02 한국과학기술원 공학 석사
- 1988.03 ~ 1994.08 한국과학기술원 공학 박사
- 1980.10 ~ 현재 한국에너지기술연구원 책임연구원
- 1998.06 ~ 2005.01 한국에너지기술연구원 센터장
- 2004.01 ~ 2005.01 한국에너지기술연구원 에너지신소재연구부장
- 2009.06 ~ 2011.01 한국에너지기술연구원 선임연구본부장
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net