기고-이슈 보고서(2)
소다석회규산염(soda lime silicate) 유리산업: 탄소배출 감축 전략
이 원고는 산업통상자원부에서 시행하는 2025년 유리·요업업종 온실가스 감축연구회 지원사업을 통하여 한국유리산업협동조합이 대한상공회의소와 협약을 체결하여 진행한 이슈페이퍼 사업 결과보고서입니다. 정부가 추진하고 있는 세라믹산업의 탄소감축 정책 목표 달성에 참고자료료 활용되길 기대하며 한국유리산업협동조합(이사장 윤국현)으로부터 제공받아 2026년 1월호부터 연재로 게재합니다. <편집자 주>
목 차
1. 서론
2. 탄소 감축을 위한 선
2.1 연소 시스템
2.1.1 Air-Fuel, Oxy-Fuel
2.1.2 Oxy-Hydrogen
2.1.3 용해로 연소 공간의 H2O 분압 및 유리 중의 H2O 농도
2.1.4 제조공정 및 품질에 미치는 H2O 농도의 영향
2.1.4.1 Oxy-Gas 연소 시스템
2.1.4.2 Oxy-Hydrogen 연소 시스템
2.1.4.3 유리중의 H2O 농도(COH) 결정
2.2 Hybrid 시스템
2.2.1 전기 용융
2.2.2 Hybrid 용융
2.2.2.1 용기유리
2.2.2.2 판유리
2.3 연소시스템 및 Hybrid 용융에 대한 고찰
2.4 파유리
2.4.1 자체 파유리
2.4.2 조성이 다른 외부 파유리
2.5 대체 원료
2.5.1 비탄산염 원료
2.5.2 기타 대체 원료
2.6 폐열 재회수
2.7 그 밖의 미래 최신 기술
3. 요약 및 결론
참고문헌 및 보도자료
맺음말
기후변화와 탄소중립
2025년 여름, 올해 우리나라 기상청의 통계 '최근 폭염·열대야 현황'에 따르면 이번 여름(6월 1일부터 8월 31일까지) 전국 평균기온은 25.7℃로 작년 여름(25.6℃)을 제치고 1973년 이후 여름 평균기온 중 1위에 올랐다고 한다. 지금부터 10년 전, 2015년 파리 기후협약이 공포되었을 때, 기후 전문가를 제외한 지구상의 보통 사람들은 지구 온난화 또는 기후변화란 생소한 단어를 체감하지 못하였지만 몇 년 전 부터 서서히 비정상적인 더위와 추위, 폭우와 가뭄 같은 기후변화를 느끼고 있다. 주된 원인은 온실가스, 그중에서 특히 탄소라 불리는 CO2의 배출이며 파리 기후협약에 따르면, “지구 온난화를 막기 위해 지구 평균 기온 상승을 산업화 이전 대비 1.5°C 또는 2°C 이하로 제한하기로 전 세계 국가들이 합의하였으며, 2016년 11월에 발효되어 2020년부터 적용되고 있다. 이 협약은 5년마다 각국이 제출한 온실가스 감축 목표를 점검하고 강화하는 등, 전 세계 모든 국가가 참여하는 최초의 기후 합의이다.” 대한민국 정부도 탄소중립을 위하여 국가차원에서 무탄소 재생에너지와 원전에너지 운영계획을 세우고 있으며, 아울러 산업 전반에 걸쳐서 탄소배출 감축을 위한 산업별 대책을 독려하고 있다.
유리의 생산은 ①주로 화석 연료의 연소에 의해 ②탄산염 원료를 함유한 뱃지를 용융하며 ③전반적인 공정의 제어는 전기에너지에 의존하기 때문에 전형적인 탄소배출 산업이다. 본 보고서에서는 soda lime silicate 유리산업을 대상으로 탄소배출 감축과 관련하여, Oxy-Gas, Oxy-Hydrogen 및 Hybrid Melting 시스템, 수분농도의 영향, 파유리 및 대체원료, 용해로 폐열 재회수를 주제로 유럽 및 미국 등의 최신 기술동향 및 탄소감축 효과를 고찰하고 국내 유리산업의 발전 방향을 모색하였다.
2025년 10월
군산대학교 신소재공학과 명예교수 김기동
2.1.3 용해로 연소 공간의 H2O 분압 및 유리 중의 H2O 농도
탄소배출 감축을 위한 산소 또는 수소의 도입은 앞서 설명한 바와 같이,
∎연소 공간에 H2O(g) 분압(PH2O)의 증가를 초래하며,
∎아울러 그림 7과 같이 이러한 H2O(g)는 용융 유리에 확산 및 용해되면서 용융 유리에 존재하는 H2O의 농도, 즉 COH 역시 증가하고,
∎용융 유리에 용해된 H2O(g)는 유리의 기본 구조 [SiO4]4- 연속 network의 O2-와 반응(H2O(g)+Si-O-Si → Si-OH-+OH--Si)에 의해서 유리 구조에 비가교 OH-(non-bridging hydroxyl ion)를 형성함으로써 유리의 전체적인 구조를 약화시키는 것으로 널리 알려져 있다[15, 16].
SLS계 유리 뱃지의 용해과정에서 “탄산염 원료에 의해서 발생하는 연소공간의 CO2 분압은 배제하고”, 오직 SLS 용융 유리를 대상으로 Air-Gas, Oxy-Gas, Oxy-Hydrogen 연소만 고려하는 경우, 공기 또는 산소와 연료(CH4 또는 H2) 사이의 이론적인 연소에 근거하여 각 연소 시스템별 연소공간 내부의 수증기 분압(Water Vapor Partial Pressure: PH2O)을 계산해 보면, 그림 8과 같이 연소 공간의 PH2O는 Air-Gas의 경우 PH2O=0.19, Oxy-Gas는 PH2O=0.67, Oxy-Hydrogen은 PH2O=1의 값을 나타낸다.
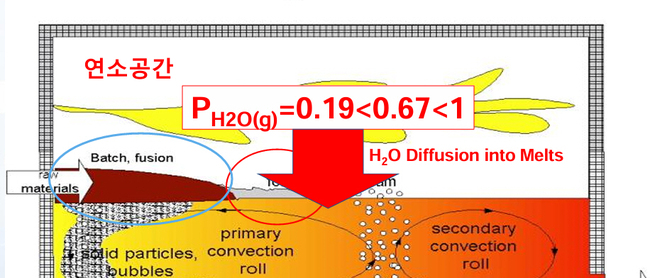
그림 7. 연소시스템에 의존하는 연소공간의 H2O분압(PH2O) 및 용융유리로의 H2O(g) 확산
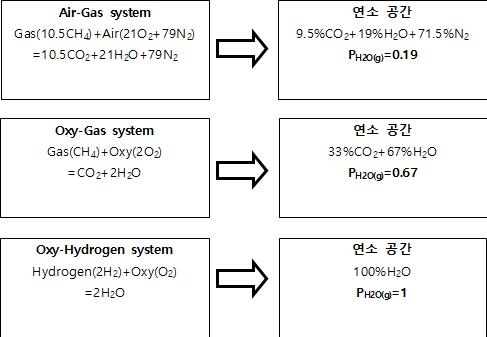
그림 8. 연료로서 Methane(CH4) Gas와 H2를 가정한 상태에서 각 연소시스템별 연소공간에서 H2O 분압(PH2O)
표 4는 Air-Gas, Oxy-Gas 연소시스템의 적용에 의해서 실제 생산되고 있는 SLS 유리를 대상으로 분석한 H2O 농도(COH)를 보여주고 있는데[5], 용해로 구조에 따라서 연소시스템별로 약간의 범위를 나타내고 있다. Oxy-Hydrogen은 아직 적용되지 않은 미래의 연소시스템이기 때문에 유리중의 실제 농도는 모르는 상태이다. 그러나 문헌에 따르면, 유리의 H2O 용해도는 에 비례하는 것으로 보고된 바[17], 표 4의 Air-Gas 및 Oxy-Gas의 데이터를 이용하여 COH와 의 관계를 설정하여 Oxy-Hydrogen 연소에 의해 제조된 유리의 COH를 예측해 보면, 그림 9에 나타난 바와 같이 약 700 ppm 이상을 보여준다. (사실 PCO2의 분압을 배제하였기 때문에 오차는 발생한다)
연소시스템 항목 | Air-Gas | Oxy-Gas | Oxy-Hydrogen |
PH2O | 0.19 | 0.67 | 1 |
COH (ppm) | 300-400 | 500-600 | 700?? |
표 4. 각 연소시스템에서 실제 생산된 SLS 유리의 H2O 농도(COH) [5], Oxy-Hydrogen은 미상
그런데, 최근 SLS 유리의 COH와 연소 공간 분압(PH2O)의 관계를 대상으로 수행한 그림 10의 Simulation결과에 따르면[18], 이미 알려진 Air-Gas, Oxy-Gas를 포함하여 Oxy-Hydrogen에 대해서 COH는 다음과 같은 범위에 있는 것으로 보인다.
∎Air-Gas는 COH 400-500 ppm
∎Oxy-Gas는 COH 500-700 ppm
∎Oxy-Hydrogen은 COH 800-1100 ppm
또한 최근에 SLS유리(⌂)를 대상으로 IHPV(Internally Heated Pressure Vessel)방법을 이용하여 직접 수분의 확산을 실험한 결과에 따르면 [19], 그림 11과 같이 로압(furnace pressure, P)=1 bar 및 PH2O=1 조건아래 1480℃에서 냉각한 유리에 존재하는 수분의 총 농도 Ctotal은 0.4 mol%를 나타내고 있으며, SLS 유리 조성(Code RAP, 74SiO216Na2O10CaO0.112H2O in mol%)에 근거하여 wt%로 환산하면 1200 ppm에 해당하는 COH를 나타내고 있다. 따라서 그림 10에서 언급한 Oxy-Hydrogen 연소에 대한 Simulation 결과, 즉 800-1100 ppm은 결코 근거가 없는 값은 아니다.
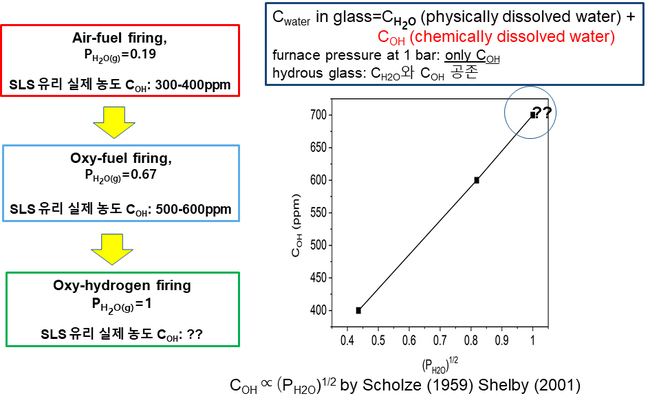
그림 9. Air-Gas 및 Oxy-Gas 연소시스템 기준 SLS 유리의 H2O 농도(COH)와 의 관계
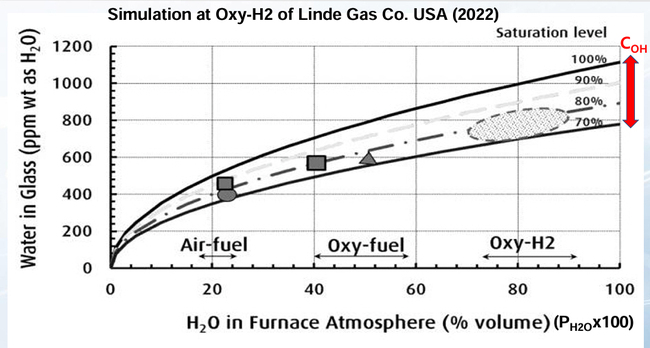
그림 10. 여러 연소시스템에서 SLS 유리의 COH와 PH2O의 관계 Simulation [18]
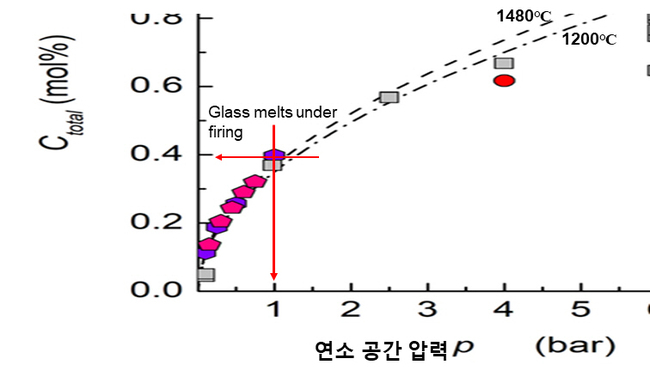
그림 11. IHPV을 이용한 1480℃에서 SLS 유리(Code RAP, ⌂)의 Ctotal(OH+H2O)과 연소공간압력(또는 로압) (P)의 관계 [19]
참고로 그림 11의 Y축에 표시한 유리에 존재하는 H2O의 총 농도 Ctotal을 구체적으로 설명하면,
∎로압(furnace pressure)이라 부르는 연소 공간 압력(P)이 1 bar, 즉 대기압까지는 PH2O=1 상태에서 수분은 앞서 언급한 유리 구조에 비가교 OH- 상태로만 존재한다. 따라서 Ctotal=COH를 의미한다.
∎그러나 연소 공간 압력이 1 bar를 초과하면, 수분은 OH- 뿐만 아니라 분자 상태(H2O)로 유리 구조의 빈 공간에 존재하며 압력(P)이 증가할수록 H2O 분자의 농도는 증가한다. 따라서 이러한 경우 Ctotal=COH+CH2O를 의미한다.
∎상업적인 유리의 경우, 로압 P≈1 bar에서 용해가 일어나기 때문에 연소시스템에 관계없이 수분은 OH- 상태로만 유리 구조에 존재 한다. 따라서 이러한 경우 H2O의 농도는 COH로 표시한다.
∎그림 9의 상단 박스에 분자상태의 H2O와 이온 상태의 OH-를 각각 physically 그리고 chemically dissolved water라는 개념으로 이러한 내용을 기술하였다.
2.1.4 제조공정 및 품질에 미치는 H2O 농도의 영향
2.1.4.1 Oxy-Gas 연소 시스템
Oxy-Gas 연소 시스템은 종래의 Air-Gas 시스템이 갖고 있는 열효율 저하 및 NOx 발생의 감소를 위해서 1990년대 초부터 적용하기 시작했는데, 초기에는 연소 공간의 PH2O(g) 상승 및 유리의 COH 증가에 기인하여 내화물 침식이 심각하였으나 새로운 전주 내화물 개발에 의한 내침식성 향상 등 시행착오를 거쳐서 오늘에 이르고 있다. 아울러 COH 증가에 기인한 Fe-redox의 변화-환원제 없이도 Fe3+/Fe2+의 감소, 비가교 OH-가 증가하여 유리 구조가 약화함으로써 고온 점도가 약간 감소하며, 앞서 그림 6에서 묘사한 water-enhanced sulfate fining 현상, 즉 수분에 의해 S의 환원에 의한 탈포 촉진 및 기포 불량 감소 그리고 결과적으로 유리의 품질 증진이라는 긍정적인 결과를 얻기도 하였다. 위와 같이 Oxy-Gas 연소시스템에서, SLS 유리의 경우 500-600 ppm에 해당하는 COH에 의해서 유리의 특성에 변화가 발생함에도 불구하고, 결론적으로 최종 용기 유리 또는 판유리의 기능에 해가 되는 변화는 보고된 바 없다. Box 3에 유리의 생산 공정 및 품질에 미치는 Oxy-Gas 연소시스템의 영향을 요약하였다.

Box 3. 유리의 생산공정 및 품질에 미치는 Oxy-Gas 연소시스템의 영향 요약
2.1.4.2 Oxy-Hydrogen 연소 시스템
Oxy-Hydrogen 연소 시스템은 Box 2에 요약한 바와 같이, 세계 여러 유리 제조 기업들이 적용가능성을 시험하였지만 아직 상업적으로 유리의 생산에 적용된 경우는 없기 때문에 실제로 유리중의 구체적인 COH 데이터는 존재하지 않는다. 다만, 그림 10에 의거하여 800-1100 ppm으로 예측할 뿐이다. 그러나 SLS 판유리를 대상으로 몇몇 성질에 미치는 다양한 COH 농도의 영향을 고찰한 최근 두 연구(19, 20)에 의거하여 제조공정 및 품질에 미치는 영향을 예측할 수 있다.
◉앞서 그림 11에서 언급한 SLS 유리를 대상으로 수행한 IHPV 실험에 의해서 도출한 로압 1기압, 연소공간 분압 PH2O=1에서 COH=1200 ppm(0.4 mol%)을 소유한 유리를 산출한 것처럼, 그림 12와 같이 애초에 75SiO215Na2O10CaO0.013H2O(mol%)의 조성(H2O 농도를 ppm으로 환산하면 약 300 ppm, Green ▼)을 소유한 유리(Code MER)가 IHPV 실험에 의해서 0.37H2O mol%(약 1100ppm, Blue ▼)의 수분을 함유한 유리로 변한다면, 점도 1012과 102 Pas 에서 각각 40 ℃와 90 ℃ 정도로 온도가 하강하는 것으로 보이며[19], 이러한 온도변화는 용해 및 성형 공정(특히 Float 유리의 경우라면 Tin Bath)에 어느 정도 영향을 미칠 것으로 예상한다.
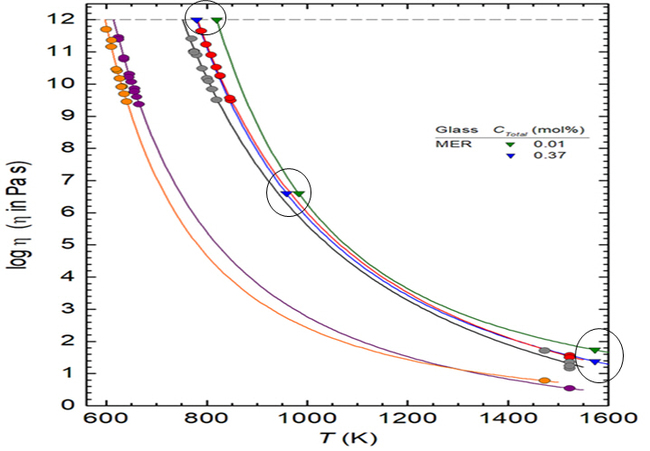
그림 12. 1기압, 분압 PH2O=1에서 SLS 유리(MER: ▼)의 COH(0.01, 0.37 mol%)가 logη(점도 수치)에 미치는 영향 [19]
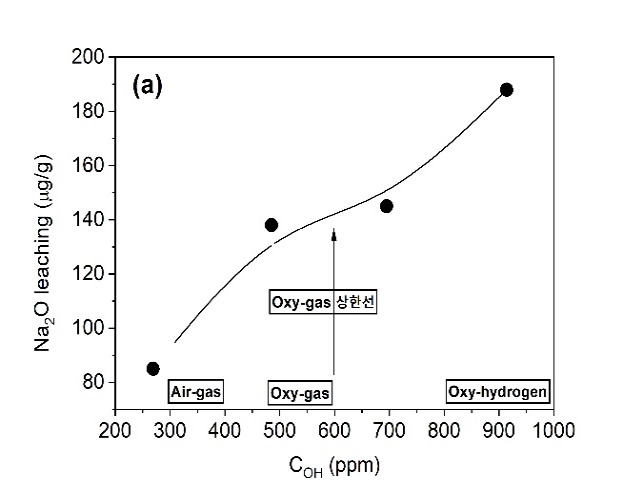
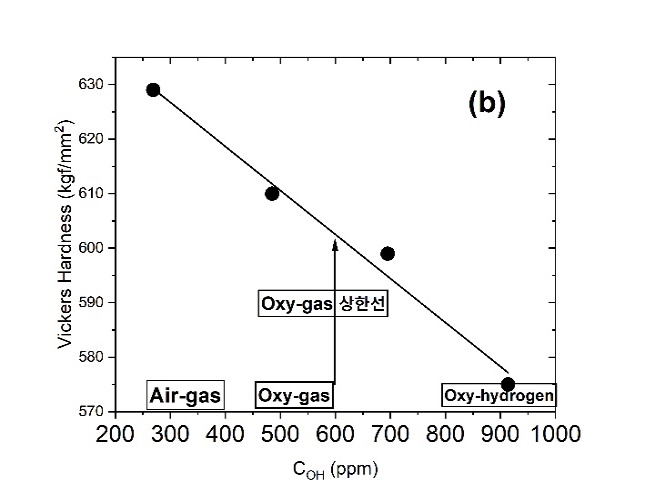
◉특히, 전형적인 Float유리 조성(72.8SiO20.55Al2O39.5CaO3.2MgO13.85Na2O 0.1Fe2O3 wt%)을 대상으로 유리의 여러 성질에 미치는 COH 농도의 영향을 관찰한 최근의 연구는 상당히 충격적인 결과를 나타내고 있는데, 표 5와 같은 Air-Gas 또는 Oxy-Gas 시스템을 이용하여 H2O/CO2의 비에 의해 연소 공간 분위기를 조절하여 269, 485, 695, 914 ppm의 다양한 COH를 소유한 유리를 제조하고, 제조한 유리들을 대상으로 아래와 같은 4 종류의 물성을 측정한 결과를 그림 13에 나타내었다[20]. (COH 측정에 관해서는 2.1.4.3 2.8mm single band 참고).
(a)화학적내구성 (Na2O leaching, 즉 Na2O 용출),
(b)표면 경도(Vickers Hardness),
(c)열팽창 계수(TEC: Thermal Expansion Coefficient),
(d)연화점 (Softening temperature: 점도 107.6 dPas에 상응하는 온도)
연소시스템 |
Air-Gas
| Oxy-Gas | ||
연소공간 분위기 (H2O:CO2) | 1:1 | 2:1 | 3:1 | |
COH (ppm) | 269 | 485 | 695 | 914 |
표 5. 다양한 연소공간 분위기에서 생산된 SLS 유리의 H2O 농도(COH) [20]
 |  |
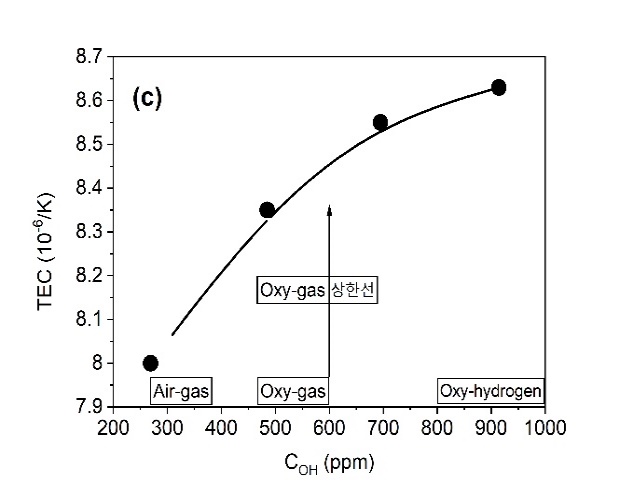 | 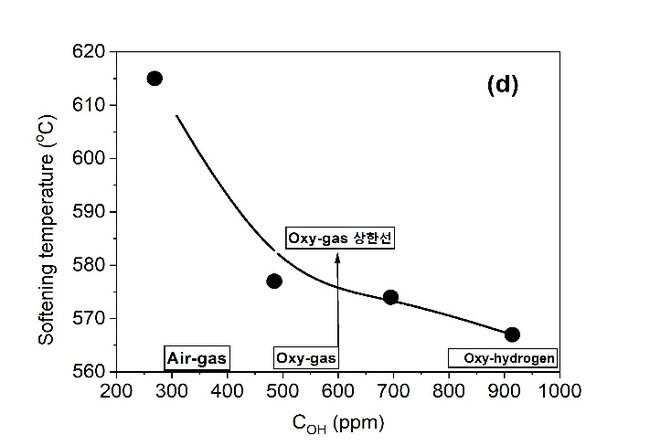 |
그림 13. SLS 판유리, 유리중의 다양한 H2O 농도(COH)에서 (a) 화학적 내구성 (Na2O 용출), (b) 표면 경도, (c) 열팽창 계수, (d) 연화점 [20]
그림 13의 결과를 해석해 보면 다음과 같다.
∎COH 농도가 증가하면서 앞서 언급한 비가교 OH-의 증가에 의한 유리 구조의 약화에 의해서 (a)Na2O leaching과 (c)열팽창 계수가 증가하며, (b)경도와 (d)연화점이 감소한다.
∎현재까지 Oxy-Gas에 의해 제조한 상업적인 SLS 유리의 COH가 그림 12에 화살표로 표시한 상한선 600 ppm에 기인하여 유리의 물성에 변화가 발생함에도 불구하고 최종 유리의 기능에 문제가 있다고 보고된 바는 없다.
∎그러나 COH가 Oxy-Gas 영역의 상한 농도 600 ppm을 통과하여 Oxy-Hydrogen 영역의 농도 하한선 800 ppm 이상에 이르면, Air-Gas 영역(269 ppm)의 Y축에 표시된 4개의 물성 항목 수치와 비교해 볼 때 상당히 큰 차이를 나타내면서 부정적인 변화가 예상된다.
∎따라서 완전히 Oxy-Hydrogen 연소시스템에서 생산된 SLS 유리를 대상으로 “과연 유리의 고유 기능이 얼마동안 가능할 수 있을까?” 하는 의심이 발생한다.
∎CO2 발생량의 감소 관점에서 Oxy-Hydrogen은 매우 훌륭한 연소 시스템이지만, 유리 생산품이 대부분 대기에 노출되고 가끔은 기계적인 충격을 받으면서 사용된다는 사실을 고려해 보면, 유리중의 H2O 농도(COH) 증가에 기인한 최종 유리의 품질, 특히 화학적 내구성 및 표면 경도 관점에서는 매우 심각해 보인다. 이러한 경우 Float유리의 조성변경이 해결책이 될 수 있으나, 결과적으로 여러 성질들의 변화가 예상된다.
2.1.4.3 유리중의 H2O 농도 (COH) 결정
앞서 언급한 바와 같이, SLS 용융유리에 확산된 H2O(g)는 유리의 [SiO4]4- 사면체구조에 Hydroxyl ion(OH-)으로 존재하여 비가교를 유발하면서 유리의 구조가 전반적으로 느슨해지기 때문에, 앞서 언급한 것처럼 유리중의 COH는 용융 유리의 성질뿐만 아니라 고체 유리의 성질에도 영향을 미친다. 이러한 이유 때문에 1994년도 삼성코닝(주)에서는 “국내 최초로 Oxy-Fuel 연소시스템에 의해 생산되었던 CRT 전면유리(Panel)”를 대상으로 품질관리의 항목으로서 유리중의 H2O 농도를 미국 Corning에서 개발한 β-OH식을 이용하여 정기적으로 측정한 경우가 있었다. 특히 COH 값이 더 높을 것으로 예상되는 Oxy-Hydrogen 연소라면, 정기적인 점검이 당연할 것이다. 따라서 Oxy-Gas와 Oxy-Hydrogen연소에서는 유리 중에 존재하는 H2O의 농도, 즉 COH 값을 정확히 결정하는 것이 매우 중요하다.
2.1.3에서 언급한 바와 같이, 상업적인 유리의 뱃지는 연소공간 압력 P»1 bar에서 용해되어 용융유리로 변하기 때문에 연소시스템에 관계없이 H2O는 유리 구조에 hydroxyl ion (OH-) 상태로만 존재 한다. 반면에 P≫1 bar의 수증기 압력에서 제조한 유리에는 OH-이외에 구조의 빈 공간에 존재하는 molecular water(H2O) 상태의 물도 존재 한다 (Box 4 참고).
유리에 존재하는 hydroxyl(OH)과 molecular water(H2O)
∎유리구조에 존재하는 hydroxyl(OH)은 “chemically dissolved water”라 불리는데 그들의 농도는 ppm 또는 mol/liter 등으로 표시한다.
∎P»1 bar에서 용해되는 산업체 유리의 경우, 연소시스템에 의존하여 최대 1000ppm이하의 H2O 농도를 함유하며 보통 hydroxyl ion(OH-)으로 존재하기 때문에 H2O 농도는 COH로 나타낸다.
∎P≫1 bar의 높은 고압의 수증기 압력에 의해서 제조한 수화유리 또는 화산분출에서 발생하는 Magma 유리의 경우, H2O 농도가 2000ppm 또는 그 이상까지 이르며, physically dissolved water라 불리는 molecular water(H2O)와 hydroxyl ion(OH-)이 함께 존재하며, 여기서 H2O 농도는 CH2O와 COH로 각각 표시하고 총 농도는 CH2O+OH와 같이 표시한다.
유리에 존재하는 hydroxyl(OH)과 molecular water(H2O) ∎유리구조에 존재하는 hydroxyl(OH)은 “chemically dissolved water”라 불리는데 그들의 농도는 ppm 또는 mol/liter 등으로 표시한다. ∎P»1 bar에서 용해되는 산업체 유리의 경우, 연소시스템에 의존하여 최대 1000ppm이하의 H2O 농도를 함유하며 보통 hydroxyl ion(OH-)으로 존재하기 때문에 H2O 농도는 COH로 나타낸다. ∎P≫1 bar의 높은 고압의 수증기 압력에 의해서 제조한 수화유리 또는 화산분출에서 발생하는 Magma 유리의 경우, H2O 농도가 2000ppm 또는 그 이상까지 이르며, physically dissolved water라 불리는 molecular water(H2O)와 hydroxyl ion(OH-)이 함께 존재하며, 여기서 H2O 농도는 CH2O와 COH로 각각 표시하고 총 농도는 CH2O+OH와 같이 표시한다. |
Box 4. 유리에 존재하는 hydroxyl ion(OH-)과 molecular water(H2O)
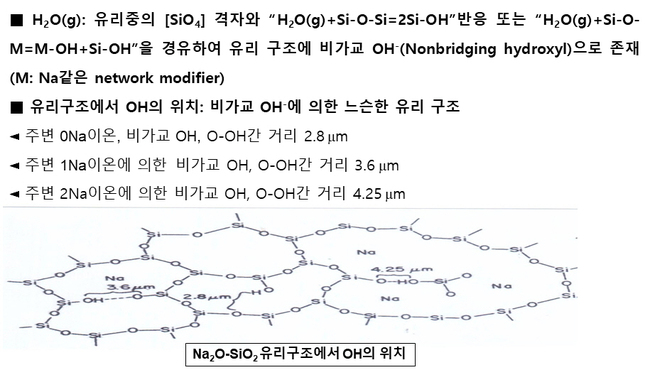
Box 5. Na2O-SiO2계 유리의 구조에서 (OH-)의 위치 및 O-OH간 거리 [15]
참고로 Na2O-SiO2계 유리의 구조에서 OH-의 위치를 살펴보면, Box 5에 나타낸 바와 같이 비가교 hydroxyl ion(OH-)의 위치에 따라서 3 종류로 구분하며, 아울러 O-OH사이의 거리는 Na+이 존재하면 증가한다. 이러한 비가교 OH-의 증가에 의해 유리의 구조는 느슨해지면서 고온 및 저온에서 유리의 여러 물리화학적 성질에 영향을 미치는 것으로 알려져 있다[15, 16].
본 보고서에서는 오직 OH-만 존재하는 COH=1000ppm (0.1wt%)이하의 SLS 유리의 경우에 한해서 여러 문헌을 참고하여 신뢰할만한 COH 결정 방법을 취급하였다.
◉COH 결정에 대한 Scholze의 제안
1995년 Geotti-Bianchini 등의 Review 논문에 따르면[21], 1959년도에 Scholze는 Soda lime silicate (SLS) 유리를 대상으로, 그림 14와 같은 적외선투과 분광분석(IR transmission spectroscopy) 결과를 토대로 유리중의 수분과 관련하여 “원(O)으로 표시한 hydroxyl(OH) stretching vibration”에 기인한 다음과 같은 3개의 흡수밴드를 발견하였는데[22], (Box 5의 이차원적인 구조 참고)
①2.8μm(3570cm-1)에서 free hydroxyl(OH) group에 기인한 흡수,
②3.6μm(2770cm-1)에서 주변의 비가교산소와 결합하여 hydrogen bond를 형성한 hydroxyl(OH) group에 기인한 흡수,
③4.3μm(2300cm-1)에서 비가교산소와 결합한 고립 사면체의 hydroxyl(OH) group에 기인한 흡수
∎특히 4.3μm근처에서 흡수밴드는 오직 특수한 분광기법에 의해서만 관찰되는 예외적인 것으로 알려져 있으며,
∎또한 SLS 유리가 Tg이상으로 상승하면 3.6μm bonded hydroxyl band가 사라지면서 2.8μm free hydroxyl band로 바뀌고 온도가 Tg 아래로 하강하면 다시 3.6μm bonded hydroxyl band로 돌아가는 가역변화를 관찰하였으며, 이러한 현상은 온도변화에 의해 유도된 구조의 변화(relaxation⇆compaction)에 기인하는 것으로 설명하였다.
(참고로 단위환산: wave number in cm-1=104/wavelength in μm)
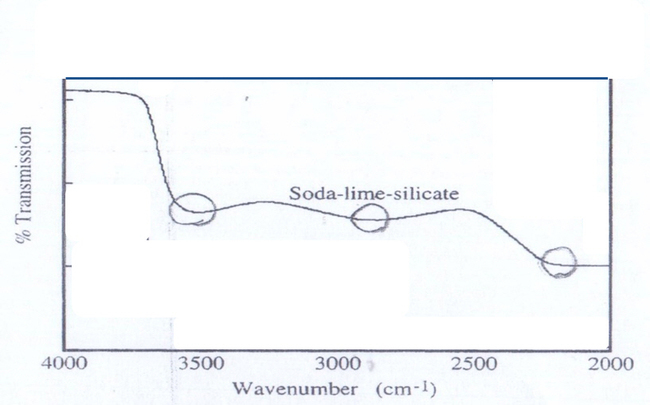
그림 14. Soda lime silicate 유리의 IR 투과 spectrum
IR 투과 spectroscopy를 이용하여 SLS 유리중의 COH를 결정하기 위해서는 “빛이 물질을 통과할 때 빛의 강도가 감소하는 현상을 설명해주는 아래와 같은 Beer-Lambert law”에 근거한 식을 이용한다.
Scholze는 COH의 결정과 관련하여,
①정밀한 값이 필요할 때는 2.8μm와 3.6μm에서 흡수에 근거하여 결정하고,
②산업체에서 routine control을 위해서 COH가 필요할 때는 (두 흡수밴드에 존재하는 OH의 비가 일정하다는 가정아래) 오직 2.8μm에서의 흡수밴드에 의거해서 결정할 것을 권고하였다.
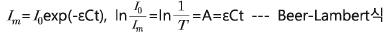
여기서, I0 : 빛의 초기강도, Im: 물질을 통과한 후의 빛의 강도, T: 투과율(Transmittance), A: 흡광도(Absorbance), ε: 몰흡광계수(molar extinction coefficient), t: 빛이 물질을 통해서 이동한 거리(두께), C: 물질의 몰 농도
◉ICG(International Commission on Glass)의 TC(Technical Committee) 14 (Gases in Glass) 제안
1999년 ICG TC14 분과는 Scholze의 제안과 여러 연구결과를 비교 검토하여 다음과 같은 두 개의 방법을 제시하였으며[23], 상호비교에 의한 정확도를 평가하였다[24].
①적외선 영역에서 “OH에 의한 흡수가 거의 없는 2.5μm(4000cm-1)에서의 투과율(T2.5)”과 OH 흡수 band가 나타나는 특정파장(2.8과 3.6μm) 근처에서의 투과율(T2.8과 T3.6)을 다음과 같은 식에 대입하여 SLS 유리 1 liter 중의 H2O mol 농도 COH(mol/l)를 결정하고, 아울러 결과의 정확도에 영향을 줄 수 있는 여러 요인들을 열거하였다.
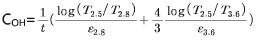
여기서, t: 유리두께 (cm), ε: 유리의 물에 대한 molar extinction coefficient 또는 absorptivity [l/(mol·cm)]. ε는 NMR 또는 NRA(Nuclear Reaction Analysis) 또는 물리적인 수분의 Vacuum Out-gassing(또는 De-gassing) 등의 방법을 이용하여 특정한 유리의 H2O 농도 절대 값을 구한 후에, 유리가 적외선의 특정파장(예: 2.8μm)에서 빛을 흡수하는 정도와 비교하여 산출되는 일종의 보정 값으로서, IR spectroscopy를 이용하여 특정 유리(조성)의 COH를 쉽게 결정하도록 도입한 값이다.
SLS 유리의 경우, 2.8μm와 3.6μm 흡수밴드를 기준으로 ε2.8: 70 l/(mol·cm), ε3.6: 150 l/(mol·cm). 또한 COH의 단위, mol/l를 흔히 사용하는 ppm 단위로 변경하기 위해서 아래의 단위전환 식을 사용한다.
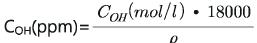
여기서 18000은 물의 분자량과 더불어 liter에서 gram 및 wt%에서 ppm으로의 전환에서 발생한 상수이며, ρ는 유리의 밀도(g/cm3)를 나타낸다.
②(2.8μm에서 free hydroxyl band와 3.6μm에서 bonded hydroxyl band의 분포가 일정하다는 가정아래) 오직 2.8μm에서의 흡수밴드와 practical extinction coefficient(εpract)를 이용하여 다음 식과 같이 SLS 유리 1mol 중의 H2O 농도 COH(mol/l)를 결정한다.
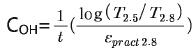
여기서 practical extinction coefficient εpract2.8는, 2.8μm에서 모든 hydroxyl group의 흡수를 나타내는 것으로 가정하는 molar extinction coefficient로서, SLS 유리의 경우 εpract2.8=40 l/(mol·cm)을 적용한다. 표 6에 여러 유리에 대한 practical extinction coefficient를 나타내었다[16]. (practical extinction coefficient는 Physical Properties Committee of the UK Society of Glass Technology에서 제공)
Glass | Wave number/length cm-1/μm | practical extinction coefficient l/(mol·cm) |
Silica | 3673/2.72 | 155 |
Boric oxide | 3580/2.79 | 141 |
Float glass | 3520/2.84 | 41 |
Container glass | 3520/2.84 | 42 |
TV panel glass | 3450/2.89 | 18 |
E-glass | 3550/2.81 | 51 |
Wool glass | 3540/2.82 | 47 |
Borosilicate glasses | 3600-3630/2.77-2.75 | 76-93 |
Aluminosilicate glasses | 3400-3500/2.94-2.85 | 72-80 |
표 6. Hydroxyl(OH) group의 흡수를 기준으로, 여러 유리의 wave number/length에서 practical extinction coefficient(εpract) [16]
◉Corning의 실용적인 방법
한편, 1970년대에 미국 Corning사는 유리에 존재하는 COH 농도로서 다음과 같은 β-OH(단위: /mm)라는 개념을 도입하여 내부적으로 사용하고 있었다[25].
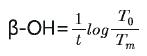
여기서, t: 유리두께(mm), To와 Tm는 이미 앞서 설명한 ICG TC14의 T2.5와 T2.8과 유사한 개념으로서, 예를 들어 아래 그림 15와 같이 적외선 영역 2~4μm에서 발생하는 base line 및 water band dip에서 투과율(%)을 의미한다.
∎코닝의 β-OH식은 기본적으로 Beer-Lambert식에 근거하여 설정된 것으로, ∎유리의 조성이 동일한 경우, practical extinction coefficient(ε)를 상수로 간주하고, H2O의 농도를 상대적으로 보여주는 간편식이다.
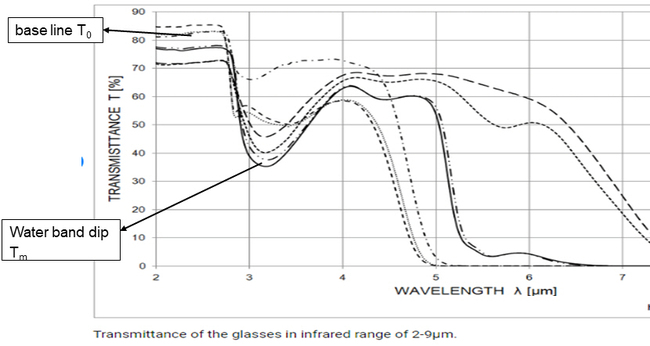
그림 15. 2~4 μm에서 base line과 water band dip에서의 투과율 To와 Tm
다음 표 7에 조성이 동일한 2 종류의 TV Panel 유리의 두께(t), To 및 Tm을 이용하여 계산한 β-OH의 예를 제시하였다. 유리의 조성은 동일하지만 Oxy-Fuel에서 제조한 Panel 유리의 H2O 농도, 즉 β-OH(0.1786)가 Air-Fuel에서 제조한 유리(0.1223)보다 증가함을 보여주고 있다.
연소시스템 및 유리 종류 | 두께 (mm) | To | Tm | β-OH |
Air-Fuel Panel Glass | 3.70 | 80.62 at 3710 cm-1 (2.69μm) | 28.45 at 3504 cm-1 (2.85μm) | 0.1223 |
Oxy-Fuel Panel Glass | 4.32 | 80.56 at 3744 cm-1 (2.67μm) | 13.63 at 3510 cm-1 (2.84μm) | 0.1786 |
표 7. 두 종의 TV Panel 유리를 대상으로 β-OH식을 이용하여 계산한 유리 중의 수분 농도
참고문헌 및 보도자료
[1] Zier, M., Stenzel, P., Kotzur, L., Stolten, D., A review of decarbonization options for the glass industry, Energy Conversion and Management: X, 10 (2021) 100083.
[2] Gonzalez A, Solorzano E, Lagos C, Lugo G, Laux S, Wu K, Bell, R., Francis, A., Kobayashi, H., Optimelt™ regenerative thermo-chemical heat recovery for oxy-fuel glass furnaces, Ceramic Engineering & Science Proceedings (A collection papers presented at the 75th Conference on Glass Problems, Ohio Nov. 2014), edit. S. K. Sundaram. The American Ceramic Society, 2015.
[3] Kobayashi, H., Future of oxy-fuel glass melting: oxygen production, energy efficiency, emissions and CO2 neutral glass melting, Ceramic Engineering & Science Proceedings (A collection papers presented at the 80th Conference on Glass Problems, Ohio Oct. 2019), edit. S. K. Sundaram. The American Ceramic Society, 2021.
[4] Brown, J. T., Kobayashi, H., Is your glass full of water?, Ceramic Engineering & Science Proceedings (A collection papers presented at the 56th Conference on Glass Problems, Ohio Oct. 1996), edit. J. Kieffer. The American Ceramic Society, 1997.
[5] Kobayashi, H., Advances in oxy-fuel fired glass melting technology, Proceeding of 20th International Congress on Glass Sep. 2004 Kyoto, Japan.
[6] Winder, S. M., Gupta, A., Selkregg, K. R., Investigation of liquid contact refractory corrosion under oxy-fuel glass melting atmosphere, Ceramic Engineering & Science Proceedings (A collection papers presented at the 58th Conference on Glass Problems, Ohio Oct. 1997), edit. J. Kieffer. The American Ceramic Society, 1998.
[7] Beerkens, R., Laimboeck, P., Kobayashi, S., The effect of water on fining, foaming and redox of sulfate containing glass melts, Ceramic Transactions Vol. 82 (Proceeding of the 5th International Conference on Advances in Fusion and Processing of Glass, Toronto, July. 1997), edit. A. Clare, L. Jones. The American Ceramic Society, 1998.
[8] Kobayashi, S., Beerkens, R., Reduction of SO2 emissions with oxy-fuel firing-“water enhanced sulfate fining”, Ceramic Transactions Vol. 82 (Proceeding of the 5th International Conference on Advances in Fusion and Processing of Glass, Toronto, July. 1997), edit. A. Clare, L. Jones. The American Ceramic Society, 1998.
[9] Beerkens, R., Laimboeck, P., Faber, A., Kobayashi, H., Interaction between furnace atmospheres and sulfate fined glass melts, Proceedings of XVIII International Congress on Glass, July 5-10, 1998, San Francisco, CA, USA.
[10] NSG to Test the World’s First Use of Hydrogen Fuel for Glass-Making | Glass Magazine
[11] Nippon Electric Glass Succeeds in Melting Glass with Combustion Technology Using a Hydrogen-Oxygen Burner | Nippon Electric Glass Co., Ltd. (neg.co.jp)
[12] AGC Achieves Success in Demonstration Test of Glass Production Using Hydrogen as Fuel | News | AGC[13]IOM3 | Flat glass production achieved using 30% hydrogen
[13] Saint-Gobain and Air Products conduct a large-scale hydrogen trial | GlassOnline.com - The World's Leading Glass Industry Website
[14] MEDIA RELEASE | Glass production without natural gas: Successful laboratory tests with 100 percent hydrogen
[15] Treatise on materials science and technology, Vol. 22, Glass III, edited by Tmozawa. M., Doremus, R. H. Academic Press 1982 75-127.
[16] Shelby, J. E., Introduction to glass science and technology, The Royal Society of Chemistry 2005 222-236.
[17] Mesko, M. G., Shelby, J. E., Water solubility and diffusion in alkali silicate melts, Phys. Chem. Glasses, 42 (2001) 173-178.
[18] Adendorff, M., Bell, R., Chakravarti, S., Kobayashi, H., Shah, M., Preparing for sustainable glass production-Technical and economic investigation of next generation fuels for glass melters, Ceramic Engineering & Science Proceedings (A collection papers presented at the 82th Conference on Glass Problems 2022), edit. S. K. Sundaram. The American Ceramic Society, 2023.
[19] Deubener, J., Behrens, H., Mueller, R., An overview on the effect of dissolved water on the viscosity of soda lime silicate melts, J. Non-Cryst. Solids X, 19 (2023) 100195.
[20] Minghan, L., Qiutong, D., Huifeng, Z., Haizeng, T., Hong, J., Microstructure and Performances of Glasses Melt under Oxy-fuel Combustion, J. Wuhan Uni. Tech.-Mater. Sci. Ed. 32 (2017) 19-22.
[21] Geotti-Bianchini, F., Riu, L., Infrared spectroscopic analysis of water incorporated in the structure of industrial soda-lime-silica glasses, Glastech. Ber. Glass Sci. Technol. 68 (1995) 228-240.
[22] Scholze, H., Der Einbau des Wassers in Gläsesern I, II, IV, Glastech. Ber. 32 (1959) 81-88, 142-152, 314-320.
[23] Geotti-Bianchini, F., Geissler, H., Kraemer, F., Smith, I., Recommended procedure for the IR spectroscopic determination of water in soda-lime-silica glass, Report of the International Commission on Glass Technical Committee 14 “Gases in Glass”, Glastech. Ber. Glass Sci. Technol. 72 (1999) 103-111.
[24] Geotti-Bianchini, F., Smith, I., Geissler, H., Nijnatten, P., Bucher, G., Intercomparison of IR transmittance measurements on water-containing glasses. Report of the International Commission on Glass (ICG) Technical Committee 14 “Gases in Glass”, Glastech. Ber. Glass Sci. Technol. 73 (2000) 308-318.
[25] Williams, J. P., Su, Y., Butler, B., Determination of water in glasses and glass-ceramics, Proceeding of XI ICG Prague (1977) 375-384.
다음호에 계속
기사를 사용하실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
https://www.cerazine.net